dr n. farm. Anna Czajkowska-Kośnik,
dr n. farm. Magdalena Wróblewska,
prof. dr hab. n. farm. Katarzyna Winnicka
– Zakład Farmacji Stosowanej, Uniwersytet Medyczny w Białymstoku
Pomimo szerokiej gamy preparatów gotowych dostępnych na rynku farmaceutycznym, lekarze nadal często przepisują pacjentom leki recepturowe. Wynika to z licznych zalet leków robionych, do których zalicza się możliwość dostosowania składu preparatu, dawki lub stężenia substancji czynnej do wieku i indywidualnych potrzeb pacjenta, także z uwzględnieniem nasilenia stanu chorobowego.
Polska receptura apteczna stawia duże wymagania pod względem jakości surowców farmaceutycznych. Substancja, która jest określana surowcem farmaceutycznym musi odpowiadać normom jakości podanym w odpowiednich przepisach, m.in. w Farmakopei Polskiej. Substancje przeznaczone do sporządzania preparatów leczniczych w zakresie receptury aptecznej muszą dodatkowo posiadać pozwolenie na dopuszczenia do obrotu wydane przez Prezesa Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych. Asortyment surowców farmaceutycznych jest stale poszerzany i uzupełniany o nowe związki przeznaczone do sporządzania preparatów recepturowych, które stanowią odpowiednio przygotowane i starannie wyselekcjonowane surowce, odpowiadające wszystkim obowiązującym standardom jakości. Nowym surowcem do receptury jest chlorowodorek klindamycyny – lek często stosowany w dermatologii oraz ginekologii.

Klindamycyna jest zaliczana do antybiotyków z grupy linkozamidów. Mechanizm działania tych antybiotyków polega na hamowaniu biosyntezy białka w komórkach bakteryjnych poprzez wiązanie się z podjednostką rybosomalną 50S i zaburzaniu wydłużania łańcucha białkowego. Linkozamidy są antybiotykami bakteriostatycznymi, ale w większych dawkach mogą wykazywać działanie bakteriobójcze. Charakteryzują się one szerokim spektrum działania. Klindamycyna jest aktywna wobec ziarenkowców Gram-dodatnich, z wyjątkiem enterokoków oraz wobec większości bakterii beztlenowych, zarówno Gram-dodatnich, jak i Gram-ujemnych, działa też przeciwpierwotniakowo. Objawy niepożądane związane z ogólnym stosowaniem klindamycyny na ogół nie są uciążliwe, choć stosunkowo często mogą wystąpić biegunka czy wysypki skórne. Klindamycyna w postaci doustnej lub dożylnej jest stosowana w leczeniu zakażeń, takich jak: zakażenia układu oddechowego, zakażenia skóry i tkanek miękkich, zakażenia kości i stawów, posocznica, zakażenia w obrębie jamy brzusznej, zakażenia żeńskich narządów płciowych, zakażenia zębów i jamy ustnej, zapalenie wsierdzia oraz w płonicy. W postaciach do stosowania na skórę wykorzystywana jest w leczeniu trądziku, a w formie kremu dopochwowego – w terapii zakażeń bakteryjnych pochwy [1]. Preparaty na polskim rynku zawierające klindamycynę występują w postaci roztworu do wstrzykiwań i infuzji, tabletek powlekanych oraz kapsułek, granulatu do sporządzania syropu, globulek i kremu dopochwowego, a także płynu, emulsji oraz żelu aplikowanych na skórę.
Klindamycyna jako substancja pro receptura występuje w postaci chlorowodorku (klindamycyny chlorowodorek, Clindamycin hydrochloride, Clindamycini hydrochloridum) i ma postać białego lub prawie białego, krystalicznego proszku, słabo higroskopijnego (rycina 1). Jest ona bardzo łatwo rozpuszczalna w wodzie, trudno rozpuszczalna w etanolu (96%) [2].

W Zakładzie Farmacji Stosowanej Uniwersytetu Medycznego w Białymstoku przeprowadzono ocenę nowej substancji pro receptura – chlorowodorku klindamycyny pod kątem możliwości jej wykorzystania w recepturze półstałych i stałych (globulki dopochwowe) postaci leków. Sporządzono preparaty dermatologiczne (o stężeniu 1%) oraz globulki dopochwowe (zawierające 150 mg chlorowodorku klindamycyny). Doboru dawki dokonano na podstawie składu recept wykonywanych w aptekach oraz preparatów handlowych. Przygotowane preparaty poddano następnie analizie m.in. organoleptycznej i mikroskopowej.
Sporządzanie leków recepturowych z chlorowodorkiem klindamycyny
Przygotowanie leków recepturowych z chlorowodorkiem klindamycyny ze względu na charakter substancji czynnej (antybiotyk) odbywało się w warunkach aseptycznych (loża z laminarnym nawiewem jałowego powietrza). Preparaty wykonano z wykorzystaniem miksera recepturowego Unguator. Ze względu na wykorzystanie substancji zmikronizowanej (informacja podana przez producenta) oraz zastosowanie podłoży zawierających wodę, w których chlorowodorek klindamycyny ulegał rozpuszczeniu, pominięto etap wstępnego rozcierania substancji leczniczej w moździerzu z częścią podłoża. Gotowe preparaty przechowywane były w szczelnych opakowaniach w temperaturze pokojowej. Składy leków recepturowych przedstawiono poniżej.
Skład preparatów dermatologicznych z chlorowodorkiem klindamycyny i metody ich sporządzenia
Rp. K1
Clindamycini hydrochloridi 1,0
Celugeli* ad 100,0
M.f. gelatum
Rp. K2
Clindamycini hydrochloridi 1,0
Lekobazae ad 100,0
M.f. cremor
Metoda wykonania
Do pojemnika Unguatora odważyć podłoże i przenieść odważoną substancję leczniczą, proponowany czas mieszania to 3 minuty, szybkość obrotów stopniowo zwiększana od 0 do 3.
Rp. K3
Clindamycini hydrochloridi 1,0
Aquae q.s.
Celugeli* ad 100,0
M.f. gelatum
Rp. K4
Clindamycini hydrochloridi 1,0
Aquae q.s.
Lekobazae ad 100,0
M.f. cremor
Metoda wykonania
Substancję leczniczą rozpuścić w jak najmniejszej ilości wody (według FP XII chlorowodorek klindamycyny bardzo łatwo rozpuszcza się w wodzie 1:1), dodać do pojemnika z odważonym podłożem. Proponowane parametry pracy Unguatora to 3 minuty, obroty stopniowo zwiększane od 0 do 3.
Rp. K5
Clindamycini hydrochloridi 1,0
Lekobazae 20,0
Aquae ad 100,0
M.f. lotion
Metoda wykonania
Substancję leczniczą rozpuścić w przepisanej ilości wody, a następnie porcjami dodawać do pojemnika z odważonym podłożem. Proponowane parametry pracy Unguatora to cykl mieszania przez 3 minuty, obroty stopniowo zwiększane od 0 do 3 – cykl powtarzany 3-krotnie.
Rp. K6
Clindamycini hydrochloridi 1,0
Glyceroli 10,0
Acidi citrici 0,07
Aquae ad 100,0
M.f. solutio
Rp. K7
Clindamycini hydrochloridi 1,0
Glyceroli 10,0
Ethanoli 70% ad 100,0
M.f. solutio
Rp. K8
Clindamycini hydrochloridi 1,0
Glyceroli 5,0
Celugeli* 60,0
Acidi citric 0,07
Aquae ad 100,0
M.f. solutio
Metoda wykonania
Przygotowanie roztworów z chlorowodorkiem klindamycyny polegało na rozpuszczaniu przepisanych substancji w wodzie lub etanolu. Proces rozpuszczania zachodził szybko w przypadku roztworów wodnych (według FP XII chlorowodorek klindamycyny bardzo łatwo rozpuszcza się w wodzie 1:1). Rozpuszczanie substancji w etanolu 70% (K7) wymagało natomiast dość długiego mieszania – 15 minut z użyciem mieszadła magnetycznego (według FP XII substancja trudno rozpuszcza się w etanolu 96%) [2]. Preparat dermatologiczny K8 przygotowano przez rozpuszczenie substancji stałych w wodzie, a następnie wprowadzenie otrzymanego roztworu w dwóch porcjach do podłoża Celugel z wykorzystaniem Unguatora. Proponowane parametry pracy to cykl mieszania przez 3 minuty, obroty stopniowo zwiększane od 0 do 3 – cykl powtarzany 3-krotnie.
* Celugel – gotowe hydrożelowe podłoże recepturowe na bazie hydroksyetylocelulozy
W przypadku globulek dopochwowych (składy poniżej) w pierwszym etapie przeprowadzono wstępne badania pozwalające określić współczynnik wyparcia dla chlorowodorku klindamycyny. W obliczeniach uwzględniono rzeczywistą pojemność form jednorazowych dla globulek, otrzymaną w wyniku standaryzacji form 3 g dla obu podłoży. Doświadczalnie wyznaczona masa podłoża przypadająca na formy 3 g wyniosła 2,7 g zarówno w przypadku masła kakaowego, jak i Witepsolu H15. Przygotowaną masę czopkową zawierającą stopione podłoże i chlorowodorek klindamycyny w dawce 150 mg wylano do form i pozostawiono w temperaturze pokojowej (Witepsol H15) lub w lodówce (masło kakaowe) do momentu zastygnięcia masy. Następnie czopki zważono i obliczono średnią masę 1 czopka. Korzystając ze wzoru, określono współczynnik wyparcia (f) dla chlorowodorku klindamycyny:
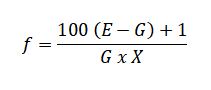
gdzie: E to masa 1 czopka bez substancji czynnej (tylko podłoże; 2,7 g), G – masa 1 czopka z substancją czynną w stężeniu X (%), a X – stężenie (%) substancji czynnej [3].
Współczynnik wyparcia (f) dla chlorowodorku klindamycyny w przypadku zastosowania masła kakaowego wyniósł 0,36, a Witepsolu H15 – 0,43.
Skład globulek recepturowych z chlorowodorkiem klindamycyny
Rp. K9
Clindamycini hydrochloridi 0,15
Acidi borici 0,05
Lactosi 0,1
Massae globulae* q.s.
M.f. glob. vag.
D.t.d. No 10
Uwagi. Do obliczeń ilości podłoża czopkowego należy wykorzystać ustalone doświadczalnie współczynniki wyparcia dla chlorowodorku klindamycyny i laktozy (fC = 0,7; fW = 0,57)** [4]. W obliczeniach nie uwzględnia się kwasu bornego z uwagi na jego niewielką ilość (<5%) [5].
Rp. K10
Clindamycini hydrochloridi 0,15
Metronidazoli 0,5
Nystatini 100 000 j.m.
Lactosi 0,25
Massae globulae* q.s.
M.f. glob. vag.
D.t.d. No 10
Uwagi. Do obliczeń ilości podłoża czopkowego należy wykorzystać ustalone doświadczalnie współczynniki wyparcia dla chlorowodorku klindamycyny, metronidazolu (fC = 0,67; fW = 0,72)** i laktozy (fC = 0,7; fW = 0,57)** [4]. W obliczeniach nie uwzględnia się nystatyny z uwagi na jej niewielką ilość (<5%) [5]. Do przygotowania globulek wykorzystano rozcierkę nystatyny o mocy 6458 j.m./1 mg.
* podłoże czopkowe stanowiło masło kakaowe lub Witepsol H15
** fC – współczynnik wyparcia dla masła kakaowego; fW – współczynnik wyparcia dla Witepsolu H15
Globulki z chlorowodorkiem klindamycyny sporządzono dwiema metodami:
- metoda wylewania z wykorzystaniem łaźni wodnej: odważone substancje lecznicze roztarto w moździerzu, a w parownicy na łaźni wodnej stopiono odważone podłoże czopkowe. Stopione podłoże połączono z roztartymi substancjami leczniczymi i następnie wylano do form na globulki. Zabezpieczone folią aluminiową przed zanieczyszczeniem globulki pozostawiono do zestalenia w temperaturze pokojowej (Witepsol H15) lub w lodówce (masło kakaowe).
- metoda wylewania z wykorzystaniem miksera recepturowego Unguator: odważono masę czopkową do pojemnika i homogenizowano w Unguatorze (czas 7 minut, szybkość obrotów zwiększana od 0 do 8). Odważone substancje lecznicze roztarto w moździerzu, a po upłynnieniu podłoża przeniesiono je do pojemnika. Kontynuowano homogenizację masy czopkowej (czas 4 minuty, szybkość obrotów zwiększana od 0 do 8). Natychmiast po homogenizacji masę czopkową wylano do form na globulki (upłynniona masa z Witepsolu H15 szybko zastyga). Zabezpieczone folią aluminiową przed zanieczyszczeniem globulki pozostawiono do zestalenia w temperaturze pokojowej (Witepsol H15) lub w lodówce (masło kakaowe).
Ocena właściwości dermatologicznych leków recepturowych
Preparaty dermatologiczne z chlorowodorkiem klindamycyny oceniano wizualnie (barwa, konsystencja, homogenność), dokonano także pomiaru pH oraz obserwacji mikroskopowych. Ocena sporządzonych preparatów odbywała się bezpośrednio po sporządzeniu oraz po 7, 14 i 30 dniach przechowywania w temperaturze pokojowej (25°C ± 2°C).
Na podstawie przeprowadzonej bezpośrednio po sporządzeniu analizy makroskopowej i sensorycznej stwierdzono, że wszystkie wykonane preparaty dermatologiczne z chlorowodorkiem klindamycyny były homogenne, bezzapachowe i charakteryzowały się dobrą rozsmarowywalnością. Wykonane maści typu emulsja oraz hydrożele z chlorowodorkiem klindamycyny charakteryzowały się jednorodnością i brakiem rozwarstwienia zarówno bezpośrednio po sporządzeniu, jak i po 30 dniach przechowywania. Po ich aplikacji i rozsmarowaniu na skórze nie wyczuwano cząstek substancji aktywnej – chlorowodorek klindamycyny ulegał rozpuszczeniu w uwodnionym podłożu lub był wprowadzany w postaci roztworu wodnego. Makroskopowo, po rozprowadzeniu preparatu cienką warstwą na szkiełku podstawowym oraz w obrazie mikroskopowym, nie obserwowano kryształów substancji czynnej (rycina 2). Przygotowane roztwory z chlorowodorkiem klindamycyny (K6-K8) były jednorodne i przezroczyste, a substancja aktywna uległa całkowitemu rozpuszczeniu.
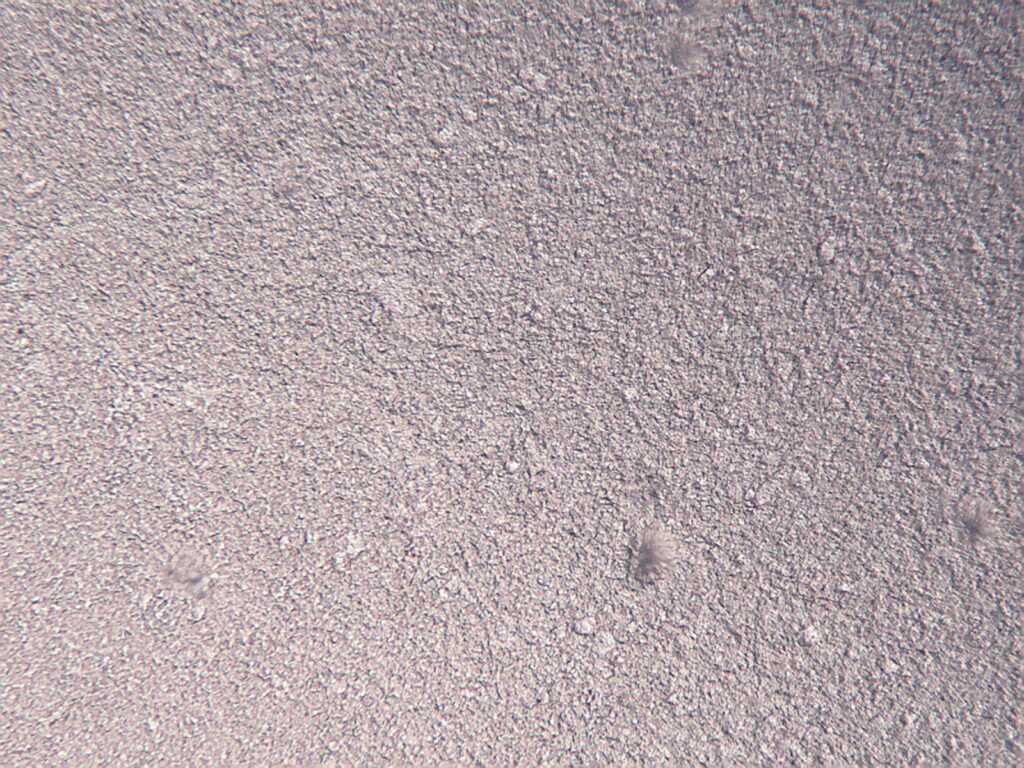

Rycina 2. Obraz mikroskopowy preparatu dermatologicznego z chlorowodorkiem klindamycyny K3 (na lekobazie): A. bezpośrednio po sporządzeniu (po lewej), B. po 30 dniach przechowywania w temperaturze pokojowej (po prawej).
Wyniki przeprowadzonej analizy trwałości pozwalają wnioskować, że sporządzone preparaty charakteryzowały się dobrą stabilnością podczas 30 dni przechowywania w temperaturze pokojowej (25°C ± 2°C). Stwierdzono, że były one homogenne i nie obserwowano wydzielenia fazy wodnej w preparatach emulsyjnych lub hydrożelowych. Roztwory wodne i etanolowe zawierające chlorowodorek klindamycyny były przezroczyste i jednorodne, nie odnotowano krystalizacji substancji. Wygląd wybranych preparatów dermatologicznych z chlorowodorkiem klindamycyny przedstawiono na rycinie 3.


Rycina 3. Wygląd wybranych preparatów dermatologicznych z chlorowodorkiem klindamycyny (K1 – Celugel, po lewej; K2 – Lekobaza, po prawej).
Dodatkowo przeprowadzono również ocenę możliwości wprowadzenia roztworu wodnego chlorowodorku klindamycyny do podłoża Celugel tak, aby otrzymać preparat dermatologiczny, który posiadałby lekką konsystencję i jednocześnie dobrze utrzymywałby się na powierzchni skóry. W tym celu do podłoża Celugel wprowadzano wodę w stosunku od 9:1 do 1:9. Zachowaną strukturę żelu oraz możliwość rozprowadzenia na skórze obserwowano w przypadku połączenia wody z podłożem Celugel w stosunku od 1:9 do 7:3 (7 części wody i 3 części Celugelu). Natomiast dodawanie kolejnych porcji wody prowadziło do nadmiernego upłynnienia preparatu.
Pomiaru pH preparatów dermatologicznych dokonano z wykorzystaniem pH-metru Orion 3 (Thermo Fisher Scientific, USA). Wartość pH wszystkich preparatów dermatologicznych z chlorowodorkiem klindamycyny była w zakresie 4,8 – 5,0 i nie uległa ona zmianom w trakcie 30 – dniowego przechowywania w temperaturze pokojowej. Uzyskane wartości pH można uznać za zgodne z wymogami jakościowymi preparatów stosowanych na skórę (pH skóry to 4,5 – 6,0) [6].
Ocena właściwości recepturowych globulek dopochwowych
Globulki dopochwowe z chlorowodorkiem klindamycyny zostały przebadane pod kątem wizualnym (wygląd, jednolitość rozproszenia substancji), określono ich twardość z wykorzystaniem twardościomierza (Tablet Hardness Tester Schleuniger 5Y, Solothurn, Szwajcaria) oraz czas rozpadu przy pomocy aparatu Electrolab (LPP Equipment, Warszawa, Polska) w temperaturze 37°C ± 0,5°C. Badanie czasu rozpadu wykonywano dla 6 globulek stosując jako płyn – bufor imitujący płyn pochwowy o pH 4,2 (zawierający chlorek sodu, wodorotlenek potasu, wodorotlenek wapnia, kwas mlekowy, kwas octowy, glicerol, mocznik, glukozę) [7]. Doświadczenie prowadzono do momentu braku niezwilżonych fragmentów masy.
Globulki (K9 i K10) wykonane metodą topienia na łaźni wodnej oraz z użyciem miksera recepturowego oceniono wizualnie oraz określono dla nich czas rozpadu i twardość. Zarówno globulki z Witepsolem H15, jak i z masłem kakaowym charakteryzowały się regularnym kształtem, jednorodną konsystencją i estetycznym wyglądem (rycina 4).
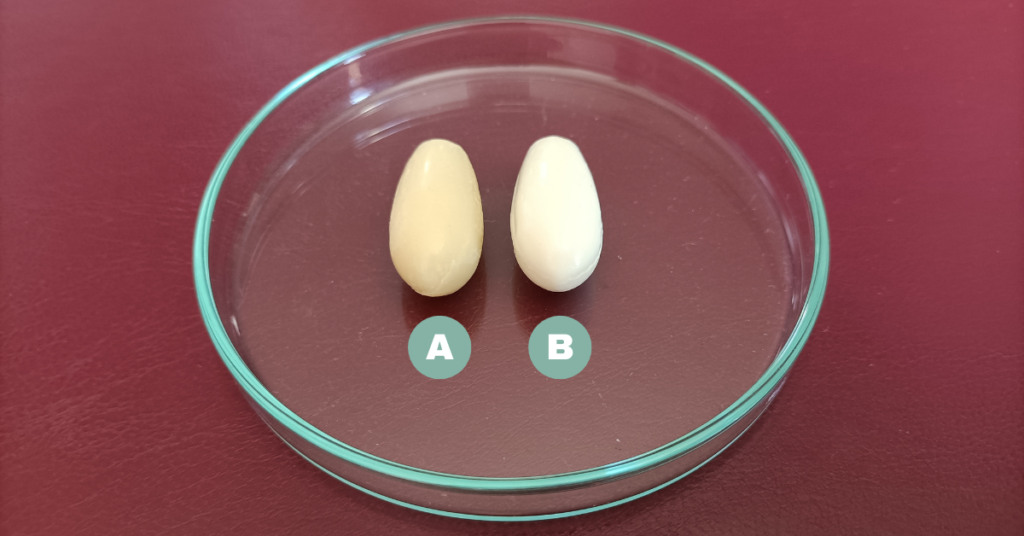
Rycina 4. Wygląd globulek dopochwowych z chlorowodorkiem klindamycyny (K10) sporządzonym z: A. masłem kakaowym i B. Wtepsolem H15, metodą z wykorzystaniem miksera recepturowego Unguator.
Badanie czasu rozpadu prowadzono w temperaturze 37ºC ± 0,5°C stosując bufor imitujący płyn pochwowy o pH 4,2. Uzyskane wyniki (tabela 3) wskazują na dłuższy (około 4-krotnie) proces rozpadu globulek wykonanych z wykorzystaniem Witepsolu H15. Jednocześnie zaobserwowano dłuższy czas rozpadu globulek wykonanych metodą topienia na łaźni wodnej, dla obu badanych podłóż czopkowych. Także kolejny parametr – twardość globulek wykazywał wyższe wartości w przypadku preparatów wykonanych z użyciem Witepsolu H15. Nie zaobserwowano znacznych różnic w twardości czopków dopochwowych wykonanych dwiema proponowanymi metodami. Uzyskane dane pozwalają wnioskować, że globulki z Witepsolem H15 charakteryzują się bardziej twardą strukturą, nie wymagają umieszczania w niskiej temperaturze w celu zestalenia masy. Stanowi to niewątpliwą zaletę podczas wyjmowania czopków z form i ich aplikacji, szczególnie w okresie letnim (brak nadtapiania czopków).
Tabela 3. Czas rozpadu globulek dopochwowych z chlorowodorkiem klindamycyny sporządzonych z użyciem masła kakaowego i Witepsolu H15 (wyniki przedstawione jako średnie z 3 pomiarów ± S.D.).
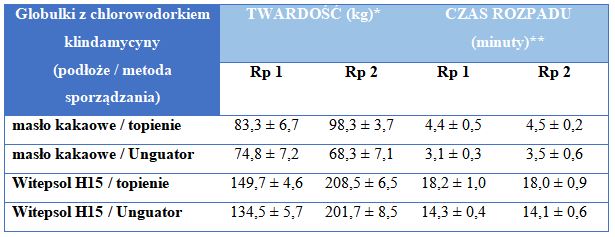
* parametr zmierzony z wykorzystaniem aparatu do badania twardości (Tablet Hardness Tester Schleuniger 5Y, Szwajcaria)
** parametr określony przy użyciu farmakopealnego aparatu do badania czasu rozpadu (Electrolab, LPP Equipment, Warszawa, Polska) w temperaturze 37ºC ± 0,5°C
Podsumowanie
- Sporządzone preparaty dermatologiczne z chlorowodorkiem klindamycyny były jednorodne, bez zapachu i charakteryzowały się dobrą rozsmarowywalnością.
- Przygotowane roztwory wodne i etanolowe z chlorowodorkiem klindamycyny były bezbarwne i przezroczyste (substancja aktywna ulegała całkowitemu rozpuszczeniu).
- Na podstawie przeprowadzonej analizy trwałości można wnioskować, że sporządzone preparaty dermatologiczne charakteryzowały się stabilnością fizykochemiczną podczas 30 dni przechowywania w temperaturze pokojowej (25°C ± 2°C).
- Globulki z chlorowodorkiem klindamycyny wykonane z wykorzystaniem Witepsolu H15 wykazywały dłuższy (około 4-krotnie) czas rozpadu, jak również wyższe wartości twardości.
- Bardziej twarda struktura globulek z Witepsolem H15 może mieć znaczący wpływ na poprawę właściwości aplikacyjnych preparatów dopochwowych (brak zmiany konsystencji i deformacji czopków podczas wyjmowania z form lub w trakcie aplikacji, szczególnie w okresie letnim).
Literatura:
- Korzeniewska-Rybicka I., Karpińska A. Klindamycyna – kompletna monografia leku. Pediatr. Med. Rodz. 2018, 14, s1–s15.
- Farmakopea Polska XII, Urząd Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych, Warszawa, 2020.
- Allen L.V. The basics of compounding: compounding suppositories, part 2-extemporaneous preparation. Int. J. Pharm. Compd. 2000, 4, 371-373.
- Czajkowska-Kośnik A., Wróblewska M., Petrykowska J., Winnicka K. O zastosowaniu podłoża czopkowego Witepsol H15 w recepturze. Aptekarz Polski 2020, 167, 36-44.
- Sznitowska M. Farmacja stosowana. Technologia postaci leku. PZWL, Warszawa 2017.
- Kaliszan R., Sznitowska M. Biofarmacja. Urban & Partner, Wrocław 2021
- Owen D.H., Katz D.F. A vaginal fluid simulant. Contraception 1999, 59, 91-95.











