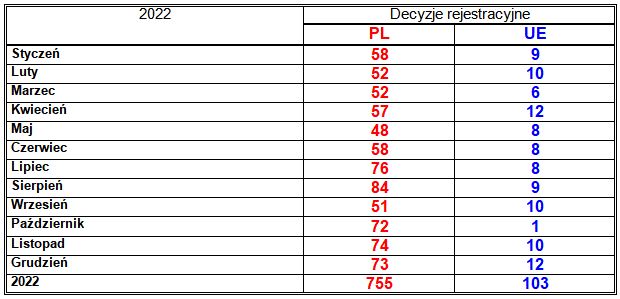
Prezes Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych wydał 755 pozwoleń na dopuszczenie do obrotu w Polsce produktów leczniczych przeznaczonych do stosowania u ludzi (2021: 646; 2020: 486; 2019: 643; 2018: 557; 2017: 824; 2016: 725; 2015: 674; 2014: 599; 2013: 786; 2012: 1269; 2011: 1413; 2010: 1344; 2009: 1164; 2008: 753), w tym 755 pozwoleń dla nowych produktów leczniczych (2021: 641; 2020: 471; 2019: 641; 2018: 549; 2017: 816; 2016: 719; 2015: 669; 2014: 586; 2013: 769; 2012: 1254; 2011: 1373; 2010: 1323; 2009: 1121; 2008: 736) i 6 nowych pozwoleń dla produktów leczniczych, które już wcześniej były zarejestrowane (2021: 5; 2020: 12; 2019: 2; 2018: 8; 2017: 8; 2016: 6; 2015: 5; 2014: 13; 2013: 9; 2012: 15; 2011: 40; 2010: 21; 2009: 43; 2008: 17). W sumie zostało zarejestrowanych 407 marek produktów leczniczych (2021: 385; 2020: 284; 2019: 343; 2018: 321; 2017: 456; 2016: 417; 2015: 394; 2014: 336; 2013: 424; 2012: 615; 2011: 711; 2010: 652; 2009: 523; 2008: 382). Podane liczby nie obejmują pozwoleń dla surowców farmaceutycznych, które nie są ujęte w „Urzędowym Wykazie Produktów Leczniczych Dopuszczonych do Obrotu na Terytorium Rzeczypospolitej Polskiej”.
Komisja Europejska w ramach procedury centralnej wydała 103 decyzje o dopuszczeniu do obrotu produktów leczniczych przeznaczonych do stosowania u ludzi (2021: 89; 2020: 90; 2019: 64; 2018: 93; 2017: 92; 2016: 81; 2015: 92; 2014: 74; 2013: 81; 2012: 65; 2011: 78; 2010: 53; 2009: 111; 2008: 55), w tym 56 decyzji dla produktów leczniczych zawierających 56 nowych substancji czynnych lub ich połączeń albo oznaczonych jako leki sieroce (tabela 1.) (2021: 52; 2020: 44; 2019: 29; 2018: 47; 2017: 36; 2016: 34; 2015: 45; 2014: 37; 2013: 36; 2012: 25; 2011: 23; 2010: 17; 2009: 31; 2008: 25) i 47 decyzji dla produktów leczniczych o substancjach czynnych już wcześniej zarejestrowanych w tej procedurze (2021: 37; 2020: 47; 2019: 35; 2018: 46; 2017: 57; 2016: 47; 2015: 47; 2014: 37; 2013: 45; 2012: 40; 2011: 55; 2010: 36; 2009: 80; 2008: 30). W sumie zostały zarejestrowane 103 marki produktów leczniczych (2021: 89; 2020: 90; 2019: 64; 2018: 93; 2017: 92; 2016: 81; 2015: 92; 2014: 74; 2013: 81; 2012: 65; 2011: 78; 2010: 53; 2009: 110; 2008: 55), w tym 24 leki sieroce. Podane liczby nie obejmują produktów leczniczych zarejestrowanych w ramach unijnej procedury centralnej, a sprowadzanych do Polski w ramach importu równoległego. Komisja Europejska zatwierdza zgłoszenia importu równoległego, ale nie publikuje wykazów produktów leczniczych zarejestrowanych centralnie, sprowadzanych do Polski w ramach importu równoległego. Produkty te nie są ujęte osobno w „Urzędowym Wykazie Produktów Leczniczych Dopuszczonych do Obrotu na Terytorium Rzeczypospolitej Polskiej” – ich zbiorczy wykaz nie jest publikowany ani nie jest podawany do wiadomości publicznej w internetowym Biuletynie Informacji Publicznej Urzędu Rejestracji, jednak są pokazywane w wyszukiwarce z Rejestru jako „opakowania z dystrybucji równoległej”. Importerzy równolegli powinni oznaczać je na opakowaniach kodami kreskowymi z własnej puli z GS1 Polska, innymi niż te same produkty lecznicze wprowadzane na rynek przez ich podmioty odpowiedzialne.
| Klasa ATC | Substancja czynna |
| A05AX | Maralixibat chloride* |
| A07EA | Budesonide* |
| A10BX | Tirzepatide |
| A16AB | Avalglucosidase alfa* |
| A16AB | Eladocagene exuparvovec* |
| A16AB | Olipudase alfa* |
| A16AX | Fosdenopterin* |
| A16AX | Lonafarnib* |
| B02BD | Eptacog beta(coagulation factor VIIa) |
| B02BD | Valoctogene roxaparvovec* |
| B06AX | Mitapivat* |
| B06AX | Voxelotor* |
| C03DA | Finerenone |
| D03AX | Betulae cortex extractum* |
| H01AC | Lonapegsomatropin |
| H01AC | Somatrogon* |
| H01CB | Octreotide* |
| H01CC | Linzagolix |
| H05AA | Abaloparatide |
| J05AE | Nirmatrelvir# |
| J05AX | Lenacapavir |
| J05AX | Maribavir* |
| J05AX | Tecovirimat |
| J06BD | Nirsevimab |
| J06BD03 | Cilgavimab# |
| J06BD03 | Tixagevimab# |
| J07BX | COVID-19 vaccine (inactivated, adjuvanted, adsorbed) |
| J07BX | Dengue tetravalent vaccine (live, attenuated): genes of serotype-specific surface proteins engineered into dengue type 2 backbone |
| L01EA | Asciminib* |
| L01EX | Capmatinib |
| L01EX | Tepotinib |
| L01FA | Mosunetuzumab* |
| L01FX | Enfortumab vedotin |
| L01FX | Loncastuximab tesirine |
| L01FX | Teclistamab |
| L01XX | Avacopan* |
| L01XX | Lisocabtagene maraleucel |
| L01XX | Ciltacabtagene autoleucel* |
| L01XX | Sotorasib |
| L01XX | Tabelecleucel* |
| L01XX | Tebentafusp* |
| L01XY03 | Relatlimab# |
| L04AA | Anifrolumab |
| L04AA | Efgartigimod alfa* |
| L04AA | Inebilizumab |
| L04AA | Sutimlimab* |
| L04AC | Spesolimab |
| L04AD | Voclosporin |
| N02CC | Lasmiditan |
| N02CD | Eptinezumab |
| N02CD | Rimegepant |
| N05CM | Daridorexant |
| N07XX | Vutrisiran* |
| R03DX | Tezepelumab |
| S01LA | Faricimab |
| V03AF | Glucarpidase* |
| V03AX | Difelikefalin |
| V09IX | Gallium [68Ga] gozetotide |
| V10XX | Lutetium [177Lu] vipivotide tetraxetan |
#jako składnik leku złożonego
Do sprzedaży wprowadzono 254 nowe marki produktów leczniczych (2021: 215; 2020: 222; 2019: 286; 2018: 250; 2017: 240; 2016: 235; 2015: 233; 2014: 305; 2013: 277; 2012: 276; 2011: 265; 2010: 335; 2009: 254; 2008: 227).
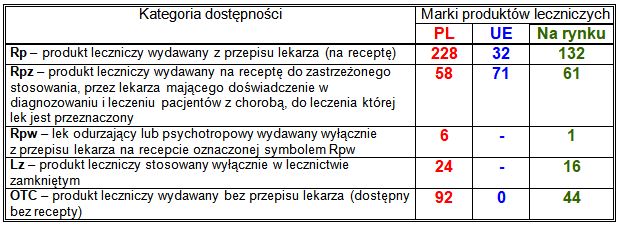
Kategorie dostępności Rpw i Lz istnieją tylko w polskich przepisach prawnych dotyczących produktów leczniczych; nie obejmują produktów z centralnej rejestracji UE. Odpowiednikiem polskich kategorii dostępności Rpw i Lz jest unijna kategoria dostępności Rpz, stosowana także w Polsce. Przedstawiony podział zarejestrowanych produktów leczniczych nie uwzględnia ewentualnych porejestracyjnych zmian kategorii dostępności – podana jest kategoria dostępności obowiązująca w dniu rejestracji.
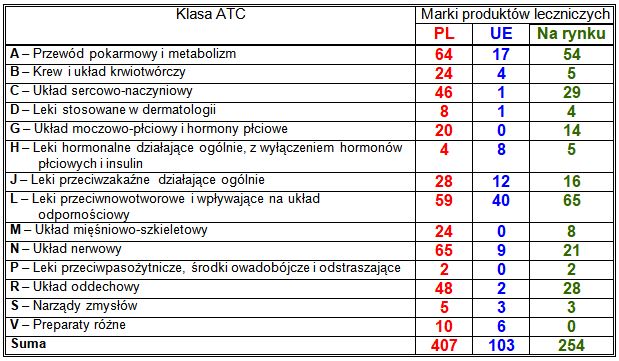
Liczba produktów leczniczych rejestrowanych w poszczególnych klasach ATC zależy od różnych czynników. Najważniejsze z nich to: liczba możliwych chorób, do leczenia których leki z danej klasy są przewidziane oraz liczba wygasających w ciągu roku i w poprzedzającym go czasie patentów na sprawdzone w lecznictwie z dobrym skutkiem substancje czynne. Mniejsze znaczenie dla rejestracji w procedurze narodowej oraz w unijnych procedurach wzajemnego uznania i zdecentralizowanej, które są objęte decyzjami Prezesa Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych, ma liczba wprowadzanych do lecznictwa nowych substancji czynnych, gdyż większość z nich jest obecnie rejestrowana w ramach unijnej procedury scentralizowanej prowadzonej przez Europejską Agencję Produktów Leczniczych (EMA). Większość produktów leczniczych rejestrowanych przez Prezesa Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych stanowią więc preparaty generyczne. Wzrost liczby leków generycznych i biopodobnych można zaobserwować także wśród produktów leczniczych rejestrowanych centralnie przez Komisję Europejską. Należy zauważyć, że niektóre podmioty odpowiedzialne rejestrują produkty lecznicze z tą samą substancją czynną i w tych samych prezentacjach pod kilkoma nazwami handlowymi.
Należy pamiętać, że nie wszystkie rejestrowane w danym roku marki są zupełnie nowe – zestawienie obejmuje także marki produktów już obecnych na rynku lub zarejestrowanych wcześniej, dla których w danym roku rejestrowane są nowe postaci lub dawki.
Duża liczba rejestrowanych i wprowadzanych na rynek nowych marek produktów leczniczych znacznie utrudnia posługiwanie się nazwami handlowymi. Istotne znaczenie mają więc nazwy międzynarodowe produktów leczniczych, których jest mniej, a dla produktów z tych samych grup terapeutycznych tworzone są na podobnej zasadzie, co ułatwia ich zapamiętywanie i kojarzenie z klasą terapeutyczną.
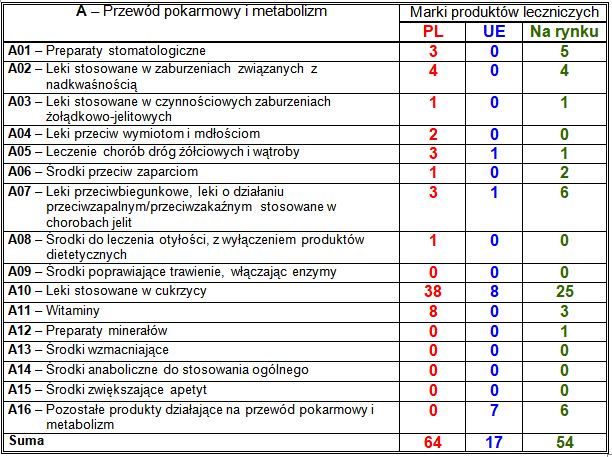
Wiodące substancje czynne w klasie A:
– PL: przeciwcukrzycowe połączenia metforminy z sitagliptyną (16 marek) i z wildagliptyną (6 marek), przeciwcukrzycowe inhibitory peptydazy dipeptydylowej IV (13 marek), w tym sitagliptyna (11 marek), witamina D3 cholekalcyferol (4 marki);
– UE: przeciwcukrzycowe połączenia metforminy z sitagliptyną (2 marki);
– nowości na rynku: przeciwcukrzycowe inhibitory peptydazy dipeptydylowej IV (14 marek), w tym sitagliptyna (11 marek) i wildagliptyna (3 marki), przeciwcukrzycowe połączenia metforminy z sitagliptyną (6 marek), środek do stosowania miejscowego w jamie ustnej benzydamina (4 marki), inhibitor pompy protonowej ezomeprazol (3 marki).
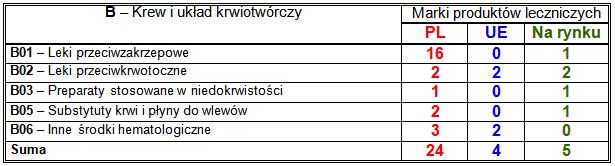
Wiodące substancje czynne w klasie B:
– PL: przeciwzakrzepowe bezpośrednie inhibitory czynnika Xa (7 marek), w tym rywaroksaban (4 marki) i apiksaban (3 marki), przeciwzakrzepowe inhibitory agregacji płytek krwi (5 marek), w tym tikagrelor (3 marki) i klopidogrel (2 marki), przeciwzakrzepowy bezpośredni inhibitor trombiny dabigatran (4 marki), stosowany w dziedzicznym obrzęku naczynioruchowym ikatybant (3 marki);
– UE: każda zarejestrowana marka zawierała inną substancję czynną;
– nowości na rynku: każda wprowadzona do sprzedaży marka zawierała inną substancję czynną.
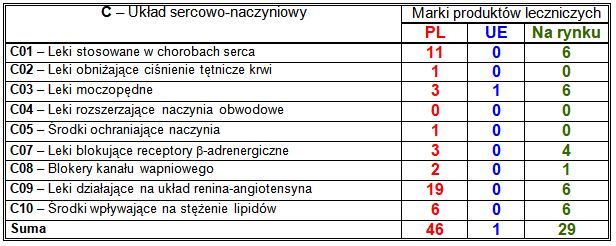
Wiodące substancje czynne w klasie C:
– PL: połączenie inhibitora konwertazy angiotensyny ramiprylu z β-blokerem bisoprololem (6 marek), pobudzający pracę serca lewozymendan (4 marki);
– UE: selektywny antagonista receptora mineralokortykoidowego finerenon (1 marka);
– nowości na rynku: selektywny bloker kanału wapniowego lerkanidypina (3 marki), lek adrenergiczny norepinefryna (2 marki), pobudzający pracę serca lewozymendan (2 marki), β-blokery (4 marki), w tym bisoprolol (2 marki), inhibitor reduktazy hydroksymetyloglutarylo-koenzymu A rosuwastatyna (2 marki).
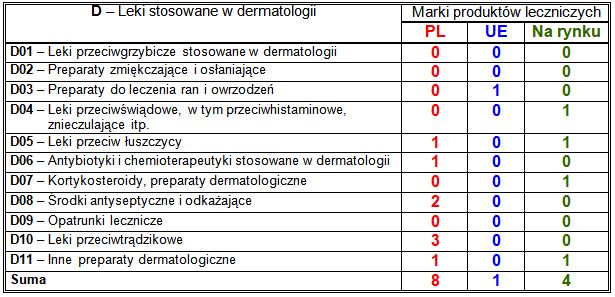
Wiodące substancje czynne w klasie D:
– PL: antyseptyczne połączenie oktenidyny z fenoksyetanolem (2 marki), działający ogólnie retynoid izotretynoina (2 marki);
– UE: wskazany w leczeniu ran wyciąg z kory brzozy (1 marka);
– nowości na rynku: każda wprowadzona marka zawierała inną substancję czynną.
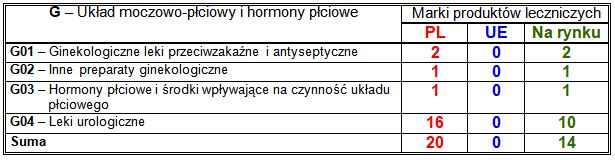
Wiodące substancje czynne w klasie G:
– PL: stosowane w zaburzeniach erekcji inhibitory swoistej dla cGMP fosfodiesterazy typu 5 (8 marek), w tym sildenafil (7 marek), stosowane w łagodnym przeroście gruczołu krokowego (6 marek), w tym połączenie tamsulozyny z solifenacyną (4 marki) i tamsulozyna (2 marki);
– nowości na rynku: stosowane w zaburzeniach erekcji inhibitory swoistej dla cGMP fosfodiesterazy typu 5 (5 marek), w tym tadalafil (4 marki), stosowane w łagodnym przeroście gruczołu krokowego (4 marki), w tym połączenie tamsulozyny z dutasterydem (2 marki) i dutasteryd (2 marki).
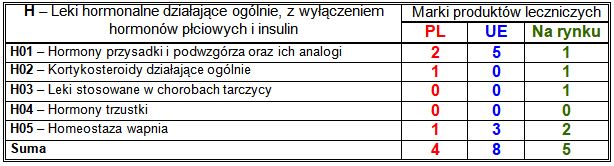
Wiodące substancje czynne w klasie H:
– PL: każda zarejestrowana marka zawierała inną substancję czynną;
– UE: analog parathormonu teryparatyd (2 marki);
– nowości na rynku: antagonista hormonów przytarczyc cynakalcet (2 marki).
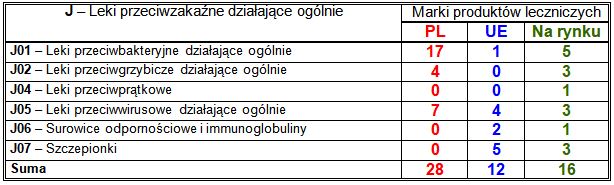
Wiodące substancje czynne w klasie J:
– PL: połączenie przeciwbakteryjnej amoksycyliny z inhibitorem beta-laktamazy kwasem klawulanowym (2 marki), przeciwbakteryjna cefalosporyna pierwszej generacji cefazolina (2 marki), działające ogólnie przeciwgrzybicze pochodne triazolu (3 marki), w tym pozakonazol (2 marki), przeciwwirusowy acyklowir (2 marki);
– UE: szczepionki przeciw COVID-19 (2 marki);
– nowości na rynku: działająca ogólnie przeciwgrzybicza pochodna triazolu flukonazol (2 marki).
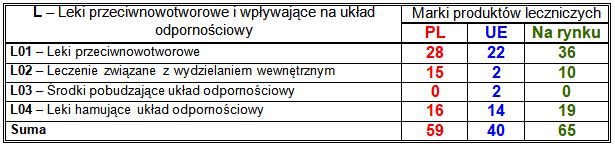
Wiodące substancje czynne w klasie L:
– PL: inhibitor biosyntezy androgenów stosowany w leczeniu raka gruczołu krokowego abirateron (14 marek), stosowany w stwardnieniu rozsianym modulator receptora fosforanu sfingozyny 1 fingolimod (7 marek), przeciwnowotworowe: inhibitory kinazy białkowej (10 marek), w tym sunitynib (7 marek) i pazopanib (2 marki), antymetabolity analogi pirymidyny (5 marek), w tym azacytydyna (4 marki), taksan kabazytaksel (4 marki), środki alkilujące analog iperytu azotowego bendamustyna (2 marki) i pochodna nitrozomocznika karmustyna (2 marki), inhibitor proteasomu bortezomib (2 marki) oraz hamujące układ odpornościowy pirfenidon (4 marki) i lenalidomid (2 marki);
– UE: hamujące układ odpornościowy fumaran dimetylu (4 marki) i selektywny teryflunomid (2 marki), przeciwnowotworowe inhibitory kinazy tyrozynowej BCR-ABL (3 marki), w tym dazatynib (2 marki) i cytotoksyczna lizosomalna pegylowana doksorubicyna (2 marki);
– nowości na rynku: inhibitory kinazy białkowej (15 marek), w tym sunitynib (11 marek) i sorafenib (2 marki), hamujące układ odpornościowy (12 marek), w tym lenalidomid (10 marek), inhibitor biosyntezy androgenów stosowany w leczeniu raka gruczołu krokowego abirateron (9 marek), antymetabolit analog pirymidyny azacytydyna (4 marki), inhibitor proteasomu bortezomib (2 marki).
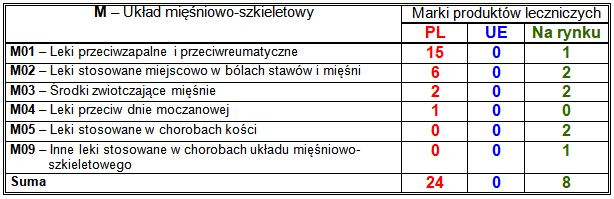
Wiodące substancje czynne w klasie M:
– PL: niesteroidowe leki przeciwzapalne i przeciwreumatyczne (15 marek), w tym pochodne kwasu propionowego (13 marek), w tym ibuprofen (6 marek) i ibuprofen w połączeniu z paracetamolem (4 marki) oraz koksyb etorykoksyb (2 marki), niesteroidowe leki przeciwzapalne stosowane miejscowo (6 marek), w tym diklofenak (3 marki) i etofenamat (2 marki);
– nowości na rynku: każda wprowadzona marka zawierała inną substancję czynną.
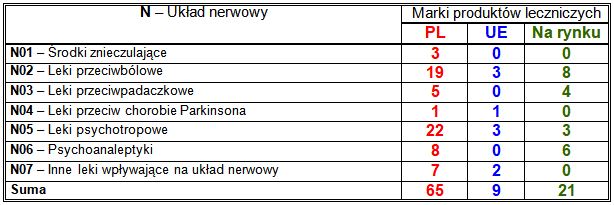
Wiodące substancje czynne w klasie N:
– PL: przeciwbólowy i przeciwgorączkowy paracetamol (5 marek), uspokajająca i przeciwdrgawkowa pochodna benzodiazepiny midazolam (5 marek); neuroleptyki arypiprazol (3 marki), paliperydon (3 marki) i klozapina (2 marki), bloker kanałów potasowych famprydyna (3 marki), leki przeciwpadaczkowe (5 marek), w tym lakosamid (2 marki) i pregabalina (2 marki), połączenie tramadolu i paracetamolu (2 marki), opioid tapentadol 2 marki), pirazolon metamizol (2 marki), połączenie metamizolu z kofeiną i tiaminą (2 marki), benzodiazepina lorazepam (2 marki), przeciwdepresyjna wenlafaksyna (2 marki), stosowana w leczeniu uzależnienia od nikotyny cytyzyniklina (2 marki);
– UE: każda zarejestrowana marka zawierała inną substancję czynną;
– nowości na rynku: przeciwdepresyjny bupropion (2 marki).

Wiodące substancje czynne w klasie P:
– PL: leki zawierające hydroksychlorochinę (2 marki);
– nowości na rynku: każda wprowadzona marka zawierała inną substancję czynną.
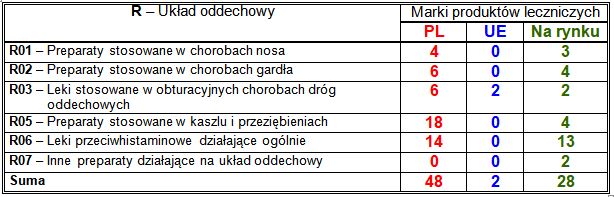
Wiodące substancje czynne w klasie R:
– PL: leki przeciwhistaminowe działające ogólnie (10 marek), w tym bilastyna (7 marek) i dezloratadyna (3 marki), leki mukolityczne (10 marek), w tym bromheksyna (3 marki), karbocysteina (3 marki), ambroksol (2 marki) i erdosteina (2 marki), przeciwkaszlowa lewodropropizyna (3 marki), wykrztuśny wyciąg z liści bluszczu pospolitego (2 marki), stosowany w przeziębieniach wyciąg z korzenia pelargonii (2 marki), przeciwhistaminowa lewocetyryzyna (2 marki), stosowane w obturacyjnych chorobach dróg oddechowych połączenia salmeterolu z propionianem flutykazonu (2 marki) i formoterolu z budezonidem (2 marki), antyseptyki stosowane w chorobach gardła (5 marek), w tym połączenia amylometakrezolu z alkoholem dichlorobenzylowym (2 marki) i benzokainy z chlorheksydyną (2 marki), donosowe połączenie sympatykomimetyku ksylometazoliny z dekspantenolem (2 marki);
– UE: każda zarejestrowana marka zawierała inną substancję czynną;
– nowości na rynku: leki przeciwhistaminowe działające ogólnie (10 marek), w tym bilastyna (9 marek), stosowana w chorobach gardła benzydamina (3 marki), donosowy kortykosteroid mometazon (2 marki), przeciwkaszlowa lewodropropizyna (2 marki).

Wiodące substancje czynne w klasie S:
– PL: każda zarejestrowana marka zawierała inną substancję czynną;
– UE: stosowane w leczeniu zaburzeń naczyniowych oka leki hamujące tworzenie nowych naczyń (3 marki), w tym ranibizumab (2 marki);
– nowości na rynku: każda wprowadzona marka zawierała inną substancję czynną.
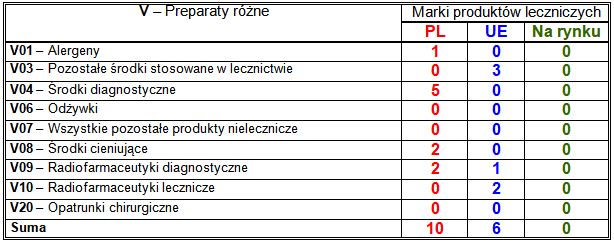
Wiodące substancje czynne w klasie V:
– PL: środek odtruwający w stosunku do leków zwiotczających sugammadeks (3 marki);
– UE: każda zarejestrowana marka zawierała inną substancję czynną.
| Podmiot odpowiedzialny | Marki produktów leczniczych |
| Zentiva | 27 |
| Aurovitas | 24 |
| Adamed | 17 |
| Sandoz | 16 |
| Solinea | 13 |
| Teva | 13 |
| Podmiot odpowiedzialny | Marki produktów leczniczych |
| Accord Healthcare | 11 |
| AstraZeneca | 5 |
| Novartis Europharm | 4 |
| Mylan | 3 |
| Pfizer | 3 |
| SERB | 3 |
| Podmiot odpowiedzialny | Marki produktów leczniczych |
| Zentiva | 19 |
| Aurovitas | 17 |
| Adamed | 9 |
| Polpharma | 9 |
| Aflofarm | 8 |
| G.L. Pharma | 8 |
| Stada | 8 |
Zestawienia nie uwzględniają dokonywanych dla niektórych produktów leczniczych porejestracyjnych zmian nazw handlowych oraz podmiotów odpowiedzialnych – uwzględniony jest stan na dzień rejestracji produktu leczniczego.
W ciągu roku następuje pewna rotacja, gdyż dla niektórych produktów leczniczych zarejestrowanych w Polsce pozwolenia wygasają: nie są przedłużane przez podmioty odpowiedzialne lub wygasają na mocy art. 31a ust. 1 ustawy Prawo farmaceutyczne (sunset clause), gdy przez 3 lata od daty rejestracji produkt leczniczy z danego pozwolenia nie zostanie wprowadzony do obrotu – dla takich produktów leczniczych Urząd Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych nie prowadzi jednak i nie publikuje osobnych bieżących wykazów, dlatego nie zostały one uwzględnione w poniższych zestawieniach.
Oprócz tego w ciągu roku następują zmiany porejestracyjne, w tym także zmiany nazw handlowych zarejestrowanych produktów leczniczych, na skutek czego niektóre marki znikają z wykazów rejestracyjnych, a na ich miejsce mogą pojawić się inne. Urząd Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych nie prowadzi jednak i nie publikuje osobnych bieżących wykazów dokonanych zmian porejestracyjnych. Według informacji Urzędu (https://www.urpl.gov.pl/pl/biuletyn-produkt%C3%B3w-leczniczych-ludzkich-i-biuletyn-weterynaryjnych-produkt%C3%B3w-leczniczych-za-2022) w roku 2022 podmioty odpowiedzialne złożyły 14229 wniosków dotyczących 30176 zmian porejestracyjnych.
Od roku 2014 na stronie internetowej Centrum e-Zdrowia (do 2020 r.: Centrum Systemów Informacyjnych Ochrony Zdrowia) została udostępniona wyszukiwarka z Rejestru Produktów Leczniczych (https://rejestrymedyczne.ezdrowie.gov.pl/rpl/search/public), lecz jej przydatność w powyższym zakresie jest ograniczona, gdyż aby wyszukać zmianę porejestracyjną, należałoby najpierw wiedzieć, czego należy szukać. Baza wyszukiwarki, dzięki wprowadzanym aktualizacjom w zakresie nowych rejestracji, stanowi jednak cenne uzupełnienie w stosunku do publikowanego corocznie „Urzędowego Wykazu Produktów Leczniczych Dopuszczonych do Obrotu na terytorium Rzeczypospolitej Polskiej” (https://dziennikmz.mz.gov.pl/DUM_MZ/2022/121/akt.pdf), szczególnie w zakresie dostępności treści charakterystyk produktów leczniczych i ulotki dla pacjenta, a także częściowo pozwoleń na dopuszczenie do obrotu.
Należy także mieć na uwadze, że w odniesieniu do produktów leczniczych rejestrowanych centralnie przez Komisję Europejską najbardziej aktualne i kompletne są informacje źródłowe dostępne na stronie Europejskiej Agencji Produktów Leczniczych (https://www.ema.europa.eu/en/medicines).
Skrócenia okresu ważności pozwoleń
Niektóre produkty lecznicze są skreślane z Rejestru na wniosek podmiotów odpowiedzialnych. Wykaz produktów leczniczych usuniętych z centralnego unijnego rejestru prowadzi i publikuje na bieżąco Komisja Europejska. Natomiast Urząd Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych od roku 2012 przygotowuje miesięczne (lub czasami zbiorcze kilkumiesięczne) zestawienia produktów leczniczych skreślonych z Rejestru na wniosek podmiotów odpowiedzialnych, jednak nie publikuje ich na swojej stronie internetowej lub w Biuletynie Informacji Publicznej, lecz jedynie udostępnia Ministerstwu Zdrowia, Głównemu Inspektoratowi Farmaceutycznemu, Narodowemu Funduszowi Zdrowia i Naczelnej Izbie Aptekarskiej.
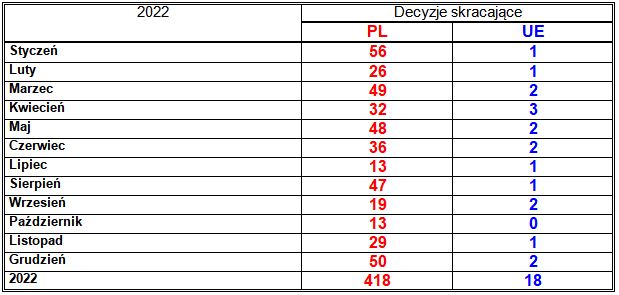
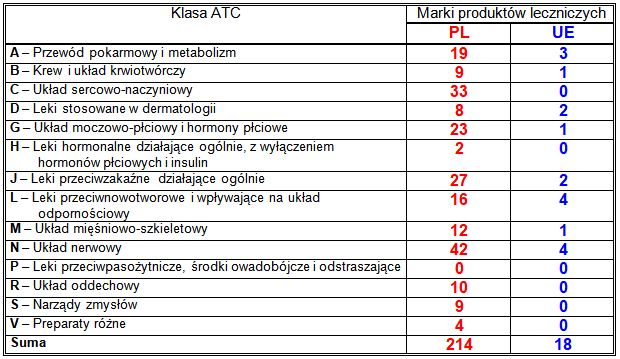
W roku 2022 Prezes Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych wydał, na wniosek podmiotów odpowiedzialnych, 418 decyzji o skróceniu okresu ważności pozwolenia (2021: 486; 2020: 437; 2019: 569; 2018: 418; 2017: 360; 2016: 337; 2015: 432; 2014: 506; 2013: 862; 2012: 545), oznaczających skreślenie z Rejestru 214 marek produktów leczniczych (2021: 235; 2020: 228; 2019: 256; 2018: 207; 2017: 159; 2016: 161; 2015: 168; 2014: 197; 2013: 308; 2012: 254). Liczby te stanowią odpowiednio 55% i 53% w stosunku do wydanych w roku 2022 decyzji rejestracyjnych i zarejestrowanych marek produktów leczniczych (2021: 75% i 61%; 2020: 93% i 81%; 2019: 88% i 75%; 2018: 71% i 64%; 2017: 44% i 35%; 2016: 46% i 39%; 2015: 64% i 43%; 2014: 84% i 59%; 2013: 110% i 73%; 2012: 43% i 41%).
Według informacji Urzędu podanych w „Biuletynie produktów leczniczych ludzkich 2022” skróconych zostało nie 418, lecz 431 pozwoleń, jednak z sumy comiesięcznych zestawień produktów leczniczych skreślonych z Rejestru wynika liczba 418 skróconych pozwoleń dla produktów leczniczych i 8 skróconych pozwoleń dla surowców farmaceutycznych (w styczniu 2022) – nie można zatem wykluczyć, że w zestawieniach miesięcznych 13 skróconych pozwoleń zostało pominiętych, w związku z tym nie mogły zostać ujęte w niniejszym opracowaniu.
W roku 2022 Komisja Europejska wycofała z unijnego Rejestru, na wniosek podmiotów odpowiedzialnych, 18 marek produktów leczniczych (2021: 26; 2020: 20; 2019: 24; 2018: 24; 2017: 13; 2016: 12; 2015: 11; 2014: 14; 2013: 10; 2012: 19), co stanowi 17% w stosunku do liczby zarejestrowanych marek produktów leczniczych (2021: 29%; 2020: 22%; 2019: 38%; 2018: 26%; 2017: 14%; 2016: 15%; 2015: 12%; 2014: 14%; 2013: 12%; 2012: 29%).
Powyższe liczby nie obejmują produktów leczniczych, dla których ważność pozwoleń wygasa z mocy prawa na skutek nie złożenia przez podmiot odpowiedzialny wniosku o rerejestrację lub na skutek nie wprowadzenia na rynek w ciągu 3 lat od rejestracji (sunset clause).
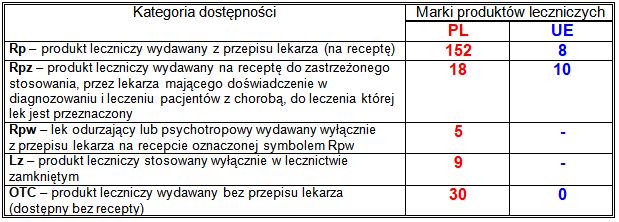
Kategorie dostępności Rpw i Lz występują tylko w polskim systemie prawnym – ich odpowiednikiem w przepisach europejskich jest kategoria dostępności Rpz.
| Podmiot odpowiedzialny | Marki produktów leczniczych |
| Sandoz | 17 |
| Mylan | 15 |
| Teva | 11 |
| Accord Healthcare | 9 |
| Zentiva | 8 |
Z unijnego Rejestru wycofano 18 produktów leczniczych 18 podmiotów odpowiedzialnych.
Skrócenia okresu ważności pozwoleń wynikają najczęściej ze zmian polityki marketingowej firm farmaceutycznych, a także zmniejszenia zapotrzebowania na niektóre starsze leki zastępowane przez leki nowsze i lepsze lub zmniejszenia poziomu sprzedaży i opłacalności produkcji przy dużej konkurencji leków, rejestrowanych często w dużej liczbie marek dla tej samej substancji czynnej. Ponadto na skutek łączenia się firm farmaceutycznych następuje korekta asortymentu leków w połączonej firmie, skutkująca najczęściej skreśleniem z Rejestru jednej z dublujących się marek leków o tej samej substancji czynnej.
Liczba skreślonych z Rejestru marek leków w ramach klas terapeutycznych i substancji czynnych jest także pochodną liczby marek dotychczas zarejestrowanych. Najwięcej skróceń okresu ważności pozwoleń dotyczyło następujących grup produktów:
w rejestrze polskim:
- klasa A – inhibitory pompy protonowej (4 marki), w tym omeprazol (3 marki), przeciwcukrzycowy inhibitor peptydazy dipeptydylowej IV wildagliptyna (3 marki) oraz połączenie metforminy z wildagliptyną (2 marki);
- klasa B – inhibitor agregacji płytek krwi kwas acetylosalicylowy (2 marki), roztwory do żywienia pozajelitowego (3 marki);
- klasa C – selektywny bloker kanału wapniowego amlodypina (4 marki), wpływający na stężenie lipidów ezetymib (4 marki), stosowana w chorobach serca trimetazydyna (3 marki), inhibitory konwertazy angiotensyny (3 marki), w tym ramipryl (2 marki);
- klasa D – lek przeciwgrzybiczy działający ogólnie terbinafina (2 marki);
- klasa G – hormonalne środki antykoncepcyjne zawierające połączenie dezogestrelu z etinylestradiolem (2 marki), estrogen estradiol (2 marki), stosowany w łagodnym przeroście gruczołu krokowego inhibitor 5α‑reduktazy testosteronu dutasteryd (2 marki), stosowany w zaburzeniach erekcji sildenafil (2 marki);
- klasa H – każde ze skróconych pozwoleń zawierało inną substancję czynną;
- klasa J – przeciwwirusowe połączenie dizoproksylu tenofowiru z emtrycytabiną (3 marki), przeciwbakteryjna cefalosporyna drugiej generacji cefuroksym (2 marki), fluorochinolon moksyfloksacyna (2 marki), lek przeciwgrzybiczy działający ogólnie anidulafungina (2 marki), przeciwwirusowy inhibitor proteazy darunawir (2 marki);
- klasa L – inhibitor kinazy tyrozynowej BCR-ABL imatynib (2 marki), inhibitor kinazy ssaków ewerolimus (2 marki), inhibitor proteasomu bortezomib (2 marki);
- klasa M – niesteroidowe leki przeciwzapalne i przeciwreumatyczne (8 marek), w tym ibuprofen (3 marki), bifosfoniany wpływające na strukturę i mineralizację kości (3 marki), w tym kwas alendronowy (2 marki);
- klasa N – leki przeciw otępieniu starczemu blokujące cholinoesterazę (5 marek), w tym donepezyl (4 marki), przeciwbólowy i przeciwgorączkowy paracetamol (3 marki), stosowane przeciw chorobie Parkinsona połączenie lewodopy z karbidopą (3 marki), połączenie opioidu oksykodonu z naloksonem (2 marki), przeciwpadaczkowa pregabalina (2 marki), przeciwdepresyjny escytalopram (2 marki), sympatykomimetyk działający ośrodkowo atomoksetyna (2 marki);
- klasa R – leki mukolityczne (3 marki), w tym ambroksol (2 marki);
- klasa S – inhibitor anhydrazy węglanowej dorzolamid (2 marki), analog prostaglandyn latanoprost (2 marki);
- klasa V – każde ze skróconych pozwoleń zawierało inne substancje czynne;
w rejestrze unijnym:
- klasa L – przeciwnowotworowy środek alkilujący temozolomid (2 marki);
- w pozostałych klasach – każde ze skróconych pozwoleń zawierało inne substancje czynne.
Opracowanie: dr n. farm. Jarosław Filipek
Kierownik Działu Informacji o Produktach
Administrator Farmaceutycznej Bazy Danych BAZYL
Przygotowanie zestawienia szczegółowego: Krystyna Skrzyńska
IQVIA
2023-03-18
Źródła:
- nomenklatura nazw substancji czynnych oraz klasyfikacja ATC na podstawie opracowania WHO Collaborating Centre for Drug Statistics Methodology (“Guidelines for ATC Classification and DDD assignment 2022”, Oslo 2021; “ATC Index with DDDs 2022”, Oslo 2021), ze zmianami i uzupełnieniami mającymi zastosowanie w roku 2022 – tłumaczenie własne;
- nomenklatura nazw substancji czynnych dla preparatów roślinnych, galenowych i szczepionek: „Farmakopea Polska XII”; “Urzędowy Wykaz Produktów Leczniczych Dopuszczonych do Obrotu na Terytorium Rzeczypospolitej Polskiej”;
- informacje rejestracyjne PL: “Urzędowy Wykaz Produktów Leczniczych Dopuszczonych do Obrotu na Terytorium Rzeczypospolitej Polskiej”; miesięczne wykazy zarejestrowanych produktów leczniczych publikowane w Biuletynie Informacji Publicznej Urzędu Rejestracji PLWMiPB; pozwolenia i decyzje porejestracyjne nadsyłane przez podmioty odpowiedzialne; wykazy produktów leczniczych, którym skrócono okres ważności pozwolenia;
- informacje rejestracyjne UE: “Community register of medicinal products for human use”; “Community list of not active medicinal products for human use”;
- informacje o wprowadzeniu produktu na rynek w Polsce: dane IQVIA;
- pozostałe opinie i komentarze: autorskie.






![Porozmawiajmy o… medycznej marihuanie [WYWIAD]](https://www.aptekarzpolski.pl/wp-content/uploads/2024/04/wywiad-medyczna-marihuana-120x86.jpg)


