Płynne postacie leków
Jeżeli substancja dobrze przenika przez błony biologiczne (grupa BCS II), pierwszym sposobem poprawy rozpuszczalności jest dodatek współrozpuszczalników np. etanolu, glikolu propylenowego czy N-metylopirolidonu. W przypadku jonizujących cząsteczek, można zmienić pH roztworu w zależności od charakteru kwasowo-zasadowego związku [Shah i wsp., 2014]. Z kolei dla cząsteczek z IV grupy BCS, czyli o słabej przenikalności, zalecane jest zastosowanie systemów lipidowych takich jak emulsje, roztwory olejowe czy dyspersje [Shah i wsp., 2014].
Jak działają cyklodekstryny?
Aby poprawić rozpuszczalność substancji stosuje się również cyklodekstryny. Są to cykliczne oligomery glukozy, z reguły pochodne β-hydroksypropylowe oraz etery sulfobutylowe. W tabeli 3 przedstawiono najczęściej stosowane cyklodekstryny. Mieszczące się na zewnątrz cząsteczki grupy hydrofilowe zapewniają ich dobrą rozpuszczalność w wodzie.
Z drugiej strony wewnętrzne grupy hydrofobowe (z nimi łączy się substancja lecznicza) ułatwiają utworzenie kompleksów inkluzyjnych typu „gość-gospodarz”. Takie kompleksy często mają lepszą przenikalność, co powoduje ich lepszą biodostępnością [Brewster i Loftsson, 2007; Muankaew i wsp., 2014; Liu i wsp., 2004, Jain i wsp., 2011].
Czytaj także: Tabletki ulegające szybkiemu rozpadowi lub rozpuszczeniu w jamie ustnej (ODT).
Stałe postacie leków
Rozpuszczalność, a co za tym idzie niejednokrotnie biodostępność stałych doustnych postaci leku, najczęściej poprawia się poprzez mikronizację substancji czynnej albo stworzenie postaci amorficznej [Anjana i wsp., 2013; Saharan i wsp, 2009]. Amorfizacja zapewnia nieuporządkowaną strukturę cząsteczki, w przeciwieństwie do uporządkowanej formy krystalicznej [Hancock i Parks, 2000; Murdande i wsp., 2010]. Dodatkowo można tworzyć kompleksy z cyklodekstrynami, co przy okazji pozwala zamaskować gorzki smak i zwiększyć trwałość substancji [Szejtli i Szente, 2005; Lee i wsp., 2010; Stojanov i wsp., 2011, Ali i wsp., 2014; Lin i wsp. 2000; Liu i wsp., 2003; Rasheed i wsp., 2008].
Czytaj także: Receptura okiem praktyka. Jak sporządzać preparaty z mocznikiem?
Tworzenie soli – potencjał w przemyśle farmaceutycznym
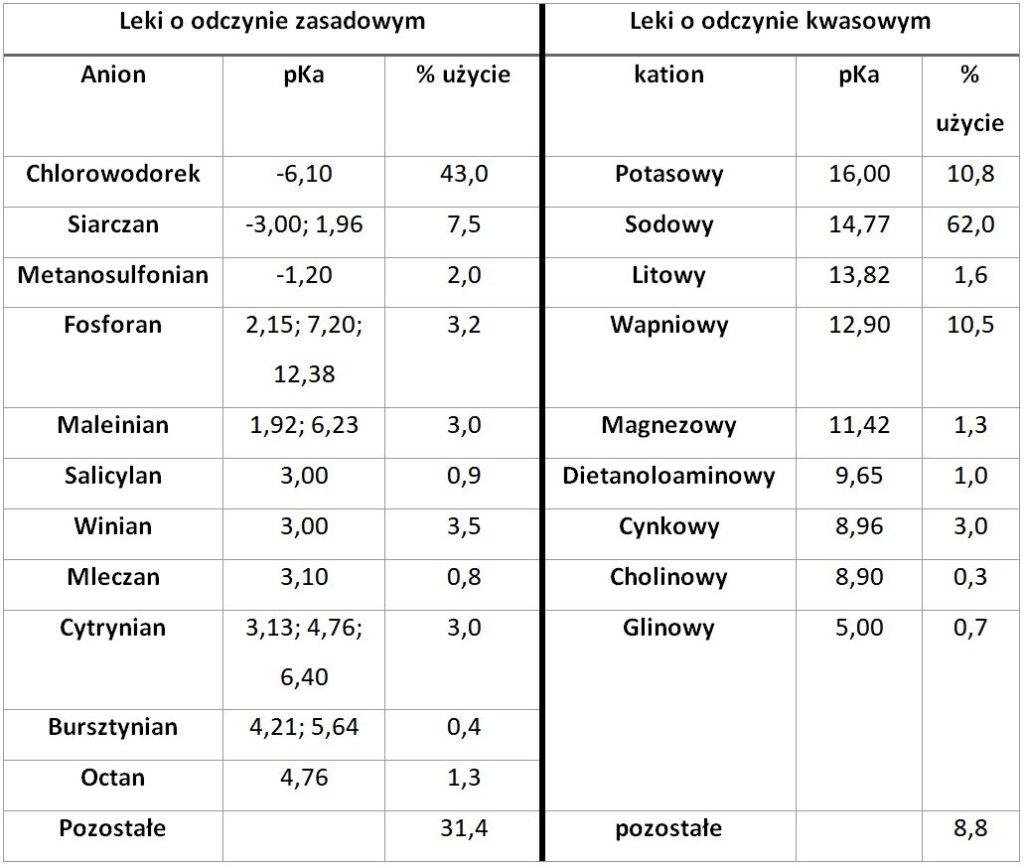
Zdolność jonizacji, a co za tym idzie tworzenia soli, posiada ok. 70% leków. Większość z nich ma charakter słabej zasady [Serajuddin, 2007; Sherif i wsp., 2008]. Do opracowania optymalnej soli niezbędna jest znajomość pKa związku macierzystego. Różnica wartości pKa dla związku i wybranej soli ΔpKa musi być większa niż 3. Tworzenie soli następuje w przypadku, kiedy oba związki są zdysocjowane w środowisku wodnym. Najważniejsze kationy i aniony wykorzystywane do tworzenia soli substancji leczniczych znajdują się w tabeli 4.
Tab. 4. Potencjalne sole wykorzystywane w przemyśle farmaceutycznym [wg Williams i wsp., 2013, modyfikacja własna]
Sól sodowa ibuprofenu, wodorosiarczan atazanawiru
Istnieje wiele cząsteczek w postaci soli, które znalazły zastosowanie w lecznictwie. Sól sodowa ibuprofenu wykazuje szybsze działanie w porównaniu do postaci wolnej, co pozwala na szybsze złagodzenie bólu [European Medicines Agency, 2009]. Z kolei atazanawir jako wolna zasada jest praktycznie nierozpuszczalny w wodzie (<1 µg/ml). Przez to wykazuje słabą biodostępność po podaniu doustnym w modelach zwierzęcych, w badaniach przedklinicznych [Kazmierski, 2011]. Dla porównania jego sole wykazują znacznie lepszą rozpuszczalność i stabilność. Wodorosiarczan atazanawiru ma najlepsze właściwości ze wszystkich soli atazanawiru np. metanosulfonianu czy chlorowodorku. Przede wszystkim, sól wodorosiarczanowa jest stabilniejsza i nie ulega hydrolizie do postaci wolnej zasady, tak łatwo jak pozostałe [Singh i wsp., 2000]. Skutkuje to znacznie wyższą biodostępnością w porównaniu do wolnej zasady i innych soli atazanawiru. Związek w postaci tej soli przeszedł badania przedkliniczne i kliniczne oraz – co najważniejsze – został dopuszczony do obrotu.
Mesylan imatynibu
Innym przykładem jest stosowany w leczeniu nowotworów imatynib. Postać wolna imatynibu ma bardzo słabą rozpuszczalność w wodzie. Jego sól w postaci mesylanu ma najlepszą rozpuszczalność przy pH <5,52 [RxList Gleevec, 2021]. Mesylan imatynibu ma dwie formy polimorficzne (α i β), z czego tylko forma β charakteryzuje się zadowalającą stabilnością [Zimmermann i wsp., 1999].
Cholinofenofibrat
Innym przykładem substancji, gdzie zastosowano sól może być fenofibrat. Jego aktywną formą jest metabolit – kwas fenofibrynowy. Opracowanie cholinofenofibratu, dobrze rozpuszczalnej i stabilnej soli tego kwasu, polepszyło biodostępność z preparatu w postaci kapsułek [Downing i wsp., 2012].
Sole kwasu acetylosalicylowego
Kolejny przykład to sól kwasu acetylosalicylowego (aspiryna lizynowa) w formie preparatu do podawania dożylnego. Badania kliniczne potwierdziły skuteczność tego preparatu, który był dobrze tolerowany przez pacjentów [Weatherall i wsp., 2010]. Również sól wapniowa kwasu acetylosalicylowego w postaci tabletek miała szybszy początek działania, niż forma wolna.
Wady i zalety zastosowania soli
Przedstawione przykłady pokazują, że można osiągnąć znaczne korzyści terapeutyczne przy zastosowaniu soli znanych od dawna substancji leczniczych. Utworzone sole rzadko różnią się profilem aktywności farmakologicznej od związków macierzystych, zmieniają się jedynie ich właściwości fizykochemiczne.
Sole mocnych kwasów lub zasad z reguły charakteryzują się nie tylko większą rozpuszczalnością, ale jednocześnie wyższą higroskopijnością. Może ona prowadzić do obniżenia stabilności preparatu. Adsorbcja wody na powierzchni tabletki może być katalizatorem degradacji leku lub hydrolizy soli do wolnego kwasu lub zasady. Niestety w wielu przypadkach nie jest to widoczne w badaniu HPLC, ponieważ obie formy wykazują podobny podział pomiędzy fazę stacjonarną i ruchomą [Guerrieri i Taylor, 2009]. Kolejnymi wadami zastosowania soli mocnego elektrolitu jest np. większa ilość odmian polimorficznych, ryzyko wystąpienia reakcji dysproporcjonowania oraz mniejsza zawartość substancji czynnej.
Czytaj także: Prosta receptura – sprawdź swoją wiedzę!








![Porozmawiajmy o… medycznej marihuanie [WYWIAD]](https://www.aptekarzpolski.pl/wp-content/uploads/2024/04/wywiad-medyczna-marihuana-120x86.jpg)


