Chloramfenikol to lek z wielu powodów interesujący i wyjątkowy. Należy do najstarszych znanych substancji antybiotycznych – wyizolowano go ponad 70 lat temu. Po drugie, stanowi jeden z bardzo nielicznych związków nitrowych obecnych naturalnie w organizmach żywych. Jest ponadto pierwszym występującym w przyrodzie antybiotykiem, który udało się zsyntetyzować i wprowadzić do masowej produkcji. Mimo poważnych działań niepożądanych wciąż odgrywa istotną rolę w leczeniu infekcji bakteryjnych, w przypadku których inne antybiotyki okazują się nieskuteczne.
Odrobina historii…
Kiedy w 1928 roku Alexander Fleming odkrył i wyizolował penicylinę, rozpoczęła się tzw. złota era antybiotyków. Naukowców opanowała gorączkowa chęć pozyskania kolejnych substancji produkowanych przez mikroorganizmy, posiadających właściwości letalne w stosunku do innych mikrobów. W trakcie trwania tej ery zidentyfikowano setki związków chemicznych o takim działaniu, których zastosowanie przyczyniło się do uratowania niezliczonych istnień ludzkich.
Odkrycie chloramfenikolu w roku 1947 to efekt kooperacji botanika Paula R. Burkholdera i jego współpracowników (Ehrlicha, Bartza, Smitha i Joslyna) z firmą Parke-Davis. Przedmiot badań stanowiły próbki ściółki bogatej w promieniowceo charakterze podobnym do pleśni. Wykazano, że wyizolowane i poddane inkubacji szczepy Streptomyces venezuelae wytwarzają substancję zdolną do hamowania wzrostu sąsiadujących z nimi bakterii chorobotwórczych. W tym samym roku Gottlieb, Anderson i Carter z Uniwersytetu w Illinois otrzymali chloramfenikol z bakterii Streptomyces pochodzących z gleby kompostowej. Opublikowane rok później wyniki ich badań zaowocowały wprowadzeniem go na rynek pod nazwą chloromycetyny.
Przeprowadzone w kolejnych latach badania potwierdziły szerokie spektrum działania otrzymanego antybiotyku. Dzięki temu został pierwszym klinicznie użytecznym antybiotykiem w leczeniu ciężkich infekcji bakteryjnych: gorączki plamistej, tyfusu, duru brzusznego. Zachęcona postępem sytuacji firma Parke-Davis postanowiła zwiększyć produkcję leku i rozpoczęto próby jego syntezy laboratoryjnej. Początkowe eksperymenty prowadziły do otrzymania cząstek, które co prawda odpowiadały budowie chloramfenikolu, ale nie wykazywały jego właściwości leczniczych.
Wreszcie zadanie syntezy chloramfenikolu powierzono Mildred Rebstock, której w 1949 roku udało się wygenerować na drodze reakcji chemicznej w pełni aktywny przeciwbakteryjnie związek. Warto zaznaczyć, że była ona jedną z niewielu kobiet, które w tamtych czasach zdołały zaistnieć w świecie nauki opanowanym przez mężczyzn. Wieść o jej sukcesie szybko obiegła światowe nagłówki gazet i zapewniła jej sporą popularność. Rebstock zmarła w 2011 roku, a wśród jej pamiątek znaleziono buteleczkę białych kapsułek opisaną ręcznie: „Chloromycetin 250 mg Recrystalized”. To, że pozostały z nią do końca jej dni świadczy, jak wielkim wydarzeniem dla niej samej był sukces z 1949 roku. Dla niej i dla całego ówczesnego świata…
Struktura chemiczna chloramfenikolu
Chloramfenikol, inaczej chloromycetyna lub detreomycyna, to według nomenklatury systematycznej D-(−)-treo-2,2-dichloro-N-[β-hydroksy-α-(hydroksymetylo)-β-(4-nitrofenylo)etylo]acetamid.
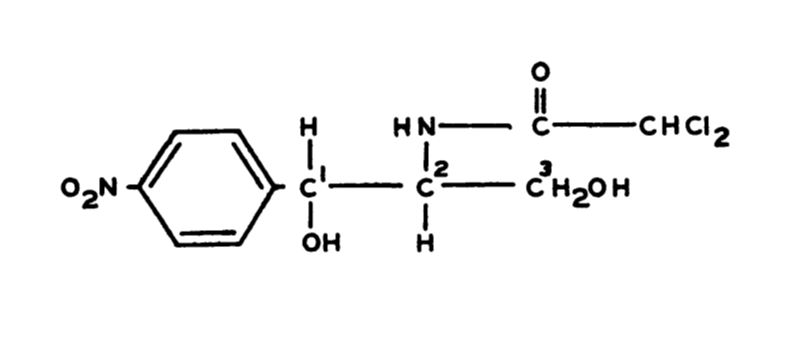
Chloramfenikol posiada w swej cząsteczce dwa asymetryczne atomy węgla (C1 i C2), w związku z czym może przyjmować postać czterech różnych stereoizomerów. Jak dotąd udało się zsyntetyzować wszystkie z nich, dzięki czemu wiadomo, że charakteryzuje je odmienna aktywność mikrobiologiczna:
- izomer D-(-)-treo posiada istotną aktywność antybiotyczną – stąd synonim detreomycyna;
- izomer L-(+)-treo wykazuje 50% aktywności izomeru D-(-)-treo;
- izomery L-(+)- i D-(-)-erytro są nieaktywne biologicznie.
Aromatyczna grupa nitrowa czyni chloramfenikol cząsteczką wyjątkową. Badacze z lat 50. XX wieku sądzili, że związki nitrowe nie występują naturalnie w przyrodzie. Dopiero badania rentgenograficzne potwierdziły strukturę chemiczną leku i pozwoliły obalić panujący ówcześnie stereotyp. Chloramfenikol pozostaje do dziś jednym z nielicznych istniejących związków nitrowych pochodzenia naturalnego.
Czytj także: Trudności i niezgodności recepturowe.











