Hemofilia jest genetyczną chorobą krwi, spowodowaną niedoborem jednego z czynników krzepnięcia krwi. Zaliczana jest do osoczowych skaz krwotocznych. Częstość występowania hemofilii w populacji w Polsce wynosi 1:12300 mieszkańców, przy czym 80-85% to hemofilia A [1]. W Polsce jest około 2500 chorych na hemofilię A w bazie danych prowadzonej przez Instytut Hematologii i Transfuzjologii w Warszawie (stan na marzec 2018 roku) [2].
Hemofilia – przyczyny i objawy
Hemofilia A to wrodzony niedobór VIII czynnika krzepnięcia, dziedziczony recesywnie i sprzężony z płcią. Geny, których mutacja dotyczy, znajdują się na chromosomie X, co oznacza, że chorują przede wszystkim mężczyźni, kobiety zaś są nosicielkami [3]. W następstwie niedoboru czynnika VIII nie jest wytwarzana dostateczna ilość trombiny przekształcającej fibrynogen w fibrynę, powstaje skrzep o słabej strukturze, łatwo ulegający rozpadowi. Skutkuje to wydłużeniem czasu krwawienia oraz samoistnymi krwawieniami wewnętrznymi i zewnętrznymi. Charakterystyczne są: artropatia hemofilowa w konsekwencji samoistnych krwawień dostawowych, krwiomocz, krwawienia z górnego odcinka przewodu pokarmowego, krwawienia środczaszkowe, krwawienia do mięśni. Krwawienia pourazowe oraz pooperacyjne są bardzo obfite, przez co trudne do zatamowania.
W zależności od stopnia niedoboru czynnika VIII wyróżniamy hemofilię ciężką – poziom aktywności czynnika <1% normy, umiarkowaną – z poziomem od 1 do 5% normy oraz łagodną – z poziomem od 5 do 40% normy. Przy czym w hemofilii łagodnej praktycznie nie obserwuje się krwawień samoistnych, występują jedynie zwiększone krwawienia po zabiegach i urazach [4].
Metody leczenia hemofilii
Jedyną metodą leczenia hemofilii jest substytucja czynników krzepnięcia [4]. Na początku XX wieku chorzy rzadko dożywali do 13 roku życia. W drugiej połowie wieku XX średni wiek przeżycia został wydłużony do około 30 roku życia, dzięki zastosowaniu przetoczeń osocza, a później krioprecypitatu chorym od zdrowych osób. Milowym krokiem w leczeniu hemofilii było pod koniec lat 60-tych XX wieku opracowanie metod frakcjonowania z osocza czynnika VIII i w dalszych latach jego produkcja z wytworzeniem produktów leczniczych zawierających liofilizowany koncentrat czynnika VIII. W latach 80-tych okazało się, iż koncentraty czynników krzepnięcia otrzymywane z osocza dawców, niosą ryzyko przenoszenia chorób zakaźnych. Stąd też opracowano metody wytwarzania rekombinowanych czynników krzepnięcia.
Przykładem rekombinowanego czynnika VIII jest oktokog alfa, który jest wytwarzany z wykorzystaniem metod inżynierii genetycznej. W Polsce zarejestrowane są dwa preparaty zawierające oktokog alfa – Advate i Kogenate Bayer [5, 6].
Mimo istotnych postępów technologicznych w otrzymywaniu koncentratów czynników krzepnięcia, hemofilia jest nadal chorobą nieuleczalną i nie ma w tej chwili leczenia przyczynowego. W leczeniu hemofilii stosuje się terapeutycznie substytucje czynnikiem krzepnięcia w momencie wystąpienia krwawienia, bądź profilaktycznie w celu utrzymania aktywności czynnika we krwi na wyższym poziomie aby zapobiegać krwawieniom.
W przypadku profilaktyki hemofilii istotne jest, aby utrzymać u chorych z ciężką postacią hemofilii poziom czynnika VIII powyżej 1% normy jak najdłużej i zapobiegać w ten sposób ewentualnym krwawieniom [7].
Optymalizacja leczenia hemofilii A – znaczenie farmakokinetyki
W związku z wysokimi kosztami leczenia koncentratami czynników krzepnięcia oraz jeszcze wyższymi kosztami leczenia powikłań krwawień zagrażającymi życiu, szczególnie istotna wydaje się optymalizacja leczenia hemofilii poprzez dostosowanie schematu dawkowania do farmakokinetyki czynnika u pacjenta.
Farmakokinetyka rekombinowanego czynnika VIII została dość dobrze opisana. Zakłada się, iż okres półtrwania oktokogu alfa wynosi średnio około 12 godzin. Jednak badania farmakokinetyczne wskazują, iż czas ten może wynosić od 6 do 25 godzin [8]. Przyjęcie okresu półtrwania czynnika VIII na poziomie 12 godzin wiąże się z koniecznością stosowania w długookresowej profilaktyce substytucji czynnika 2-3 razy w tygodniu.
Podane w charakterystykach produktu leczniczego wskazówki do obliczania dawki czynnika VIII na podstawie wieku i masy ciała, a także obserwacji empirycznych, okazują się niewystarczające do określenia optymalnej dawki [5, 9]. Stąd próby indywidualizacji dawkowania czynnika VIII w oparciu także o farmakokinetykę leku u chorych, aby odpowiednio dobrać schemat dawkowania (wielkość dawki oraz częstość podawania) i zabezpieczyć chorego przed krwawieniami, a także zwiększyć compliance oraz komfort życia poprzez redukcję hospitalizacji.
Określenie farmakokinetyki rekombinowanego czynnika VIII u pacjenta wymaga pobrania standardowo 8 próbek krwi w czasie do 48 godzin od momentu dożylnego podania. Badania te wymagają zatem dodatkowego zaangażowania personelu medycznego, a także częstych wizyt pacjenta w ośrodku leczenia hemofilii lub kilkudniowej hospitalizacji. W określaniu farmakokinetyki czynnika VIII i wyznaczaniu dawkowania pomocne okazały się założenia farmakokinetyki populacyjnej.
Teoria farmakokinetyki populacyjnej została stworzona w latach 70-tych XX wieku i została szeroko rozwinięta i powszechnie zaakceptowana w latach 90-tych. W roku 1999 założenia farmakokinetyki populacyjnej zostały zaakceptowane przez FDA jako metoda określania dawki leku w oparciu o dane populacyjne. W dużym badaniu z ponad 150 pacjentami z hemofilią A określono model farmakokinetyki populacyjnej czynnika VIII z uwzględnieniem wieku i masy ciała [9].
Stworzenie modelu farmakokinetyki populacyjnej czynnika VIII dostarczyło podstaw do określania zindywidualizowanej farmakokinetyki na podstawie pojedynczych próbek i z pomocą modelu prawdopodobieństwa Bayesa. W modelu bayesowskim przyjmujemy prawdopodobieństwo a priori wystąpienia szukanego parametru w oparciu o dostępne dane. Otrzymujemy gęstość rozkładu prawdopodobieństwa szukanego parametru. Model bayesowski umożliwia indywidualne oszacowanie farmakokinetyki, gdy dostępne są tylko dane z pojedynczej próbki.
Wykorzystując ten model stworzono oprogramowanie myPKFiT. Jest to aplikacja, wykorzystująca model farmakokinetyki populacyjnej z algorytmem bayesowskim, dedykowana do produktu Advate w celu wyznaczania indywidualnego profilu farmakokinetycznego rekombinowanego koncentratu czynnika VIII u pacjenta i obliczania na tej podstawie optymalnego dawkowania. Oprogramowanie myPKFiT zostało zatwierdzone przez FDA w roku 2017 jako program farmakokinetyczny służący do określania dawkowania Advate. W Polsce oprogramowanie ma status wyrobu medycznego od 2014 roku.
Oprogramowanie umożliwia ocenę profilu farmakokinetycznego Advate u pacjenta na podstawie pomiaru aktywności czynnika tylko w 2 próbkach krwi: pierwszej – pobranej 3-4 godziny po podaniu czynnika oraz drugiej – 24-32 godziny po podaniu. Oprogramowanie wymaga uwzględnienia także wieku pacjenta, wagi oraz wyjściowego poziomu aktywności czynnika VIII, zmierzonego bezpośrednio przed podaniem leku. myPKFiT wykorzystując wprowadzone indywidualne dane pacjenta oraz założenia farmakokinetyki populacyjnej oblicza dane farmakokinetyczne leku u pacjenta. Następnie na podstawie tych danych program oblicza odpowiednią dawkę oraz optymalną częstotliwość podania do osiągniecia pożądanej aktywności czynnika VIII. Dzięki temu lekarz prowadzący ma możliwość doboru takiego schematu dawkowania, aby ograniczyć do minimum czas, kiedy aktywność czynnika spada poniżej 1% i zabezpieczyć pacjenta przed krwawieniami.
Badania wskazują, iż indywidualizacja dawkowania na podstawie wyliczeń myPKFiT prowadzi do znacznej redukcji krwawień u chorych, podnosząc komfort życia oraz zmniejszając liczbę potrzebnych hospitalizacji [10].
Opis przypadków – zastosowanie myPKFiT w optymalizacji dawkowania Advate w profilaktyce hemofilii A
Przypadek 1: 10-letni chłopiec z hemofilią A, waga 27 kg, naturalny poziom czynnika VIII < 1%, leczony w Klinice Pediatrii Onkologii i Hematologii, Uniwersyteckiego Dziecięcego Szpitala Klinicznego w Białymstoku. Na podstawie przeprowadzonych badań z wykorzystaniem dwóch próbek krwi pobranych od pacjenta 3 godziny i 24 godziny po podaniu Advate i zastosowaniem oprogramowania myPKFiT, wyznaczono farmakokinetykę czynnika VIII. Obliczony okres półtrwania wynosił 9,2 godziny, natomiast czas aktywności czynnika VIII powyżej 1% wynosił 48 godzin. Na podstawie wprowadzonych danych pacjenta (wiek i waga) oraz wyznaczonych, w oparciu o model bayesowski, parametrów farmakokinetycznych, oprogramowanie wyznaczyło dawkę i częstość podania Advate, które pozwoliły utrzymać aktywność czynnika powyżej 1%. Zaproponowany przez myPKFiT schemat dawkowania Advate u pacjenta to 1000 j.m. 4 razy w tygodniu (poniedziałek-środa-piątek-niedziela). Wykres z oprogramowania myPKFiT uwzgledniający dawkowanie oraz aktywność czynnika VIII po podaniu Advate przedstawia Rycina 1.
Przypadek 2: 12-letni chłopiec z hemofilią A, waga 25 kg, naturalny poziom czynnika VIII < 1%, leczony w Klinice Pediatrii Onkologii i Hematologii, Uniwersyteckiego Dziecięcego Szpitala Klinicznego w Białymstoku. Na podstawie przeprowadzonych badań z wykorzystaniem dwóch próbek krwi pobranych od pacjenta 3 godziny i 24 godziny po podaniu Advate i zastosowaniem oprogramowania myPKFiT, wyznaczono farmakokinetykę czynnika VIII. Obliczony okres półtrwania wynosił 11,8 godziny, natomiast czas aktywności czynnika VIII powyżej 1% wynosił 68 godzin. Zaproponowany przez myPKFiT schemat dawkowania Advate u pacjenta to 1000 j.m. 3 razy w tygodniu (poniedziałek-środa-piątek). Wykres z oprogramowania myPKFiT uwzgledniający dawkowanie oraz aktywność czynnika VIII po podaniu Advate przedstawia Rycina 2. W Tabeli 1 porównano parametry farmakokinetyczne Advate wyznaczone u pacjentów.
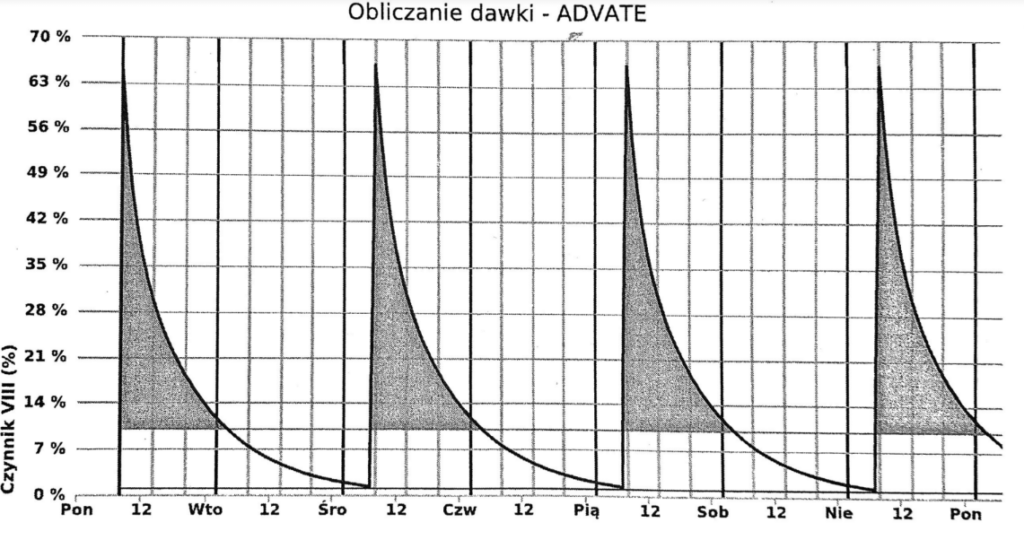
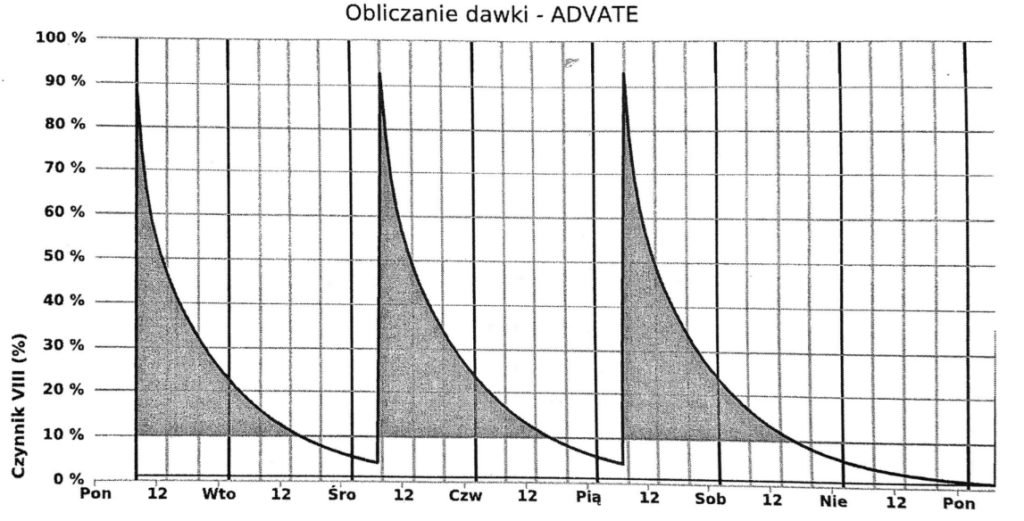
Tabela 1. Porównanie parametrów farmakokinetycznych Advate u dwóch pacjentów.
| Pacjent 1 | Pacjent 2 | |
| Klirens [dl/h/kg] | 0,044 | 0,032 |
| Okres półtrwania czynnika VIII [h] | 9,2 | 11,8 |
| Objętość w stanie stacjonarnym [dl/kg] | 0,5 | 0,5 |
| Czas z poziomem czynnika powyżej 1% po podaniu [h] | 48 | 68 |
| Czas z poziomem czynnika powyżej 10% po podaniu [h] | 20 | 32 |
| Dawkowanie | 4 x w tygodniu | 3 x w tygodniu |
Dzięki zastosowaniu oprogramowania myPKFiT zoptymalizowano schemat dawkowania Advate, dostosowując dawkę i częstość podania do indywidualnego pacjenta, uzyskując u każdego z nich pożądany poziom czynnika VIII zabezpieczający przed krwawieniami. Dzięki temu możliwa jest optymalizacja zużycia koncentratu czynnika VIII oraz co równie istotne, podniesienie jakości życia chorych poprzez zmniejszenie ryzyka krwawień i hospitalizacji związanej z leczeniem ich powikłań.
dr n. farm. Dominik Popławski,
Regionalne Centrum Krwiodawstwa i Krwiolecznictwa w Białymstoku
dr hab. Anna Gromotowicz-Popławska,
Zakład Biofarmacji, Uniwersytet Medyczny w Białymstoku
dr n. med. Łucja Dakowicz,
Klinika Pediatrii Onkologii i Hematologii, Uniwersytecki Dziecięcy Szpital Kliniczny
dr n. farm. Marta Baranowska-Kuczko,
Zakład Farmacji Klinicznej, Uniwersytet Medyczny w Białymstoku
Piśmiennictwo:
- Windyga J, Chojnowski K, Klukowska A i wsp.: Część I: Wytyczne postępowania w hemofilii A i B niepowikłanej inhibitorem czynnika VIII i IX (wydanie zaktualizowane), Act Haematol Polon, 2016; 47: 86-114.
- Narodowy program leczenia chorych na hemofilię i pokrewne skazy krwotoczne na lata 2019-2023.
- Bolton-Maggs PH, Pasi KJ.: Haemophilias A and B. Lancet, 2003; 361: 1801-1809.
- Windyga J.: Hemofilia A i hemofilia B, Medycyna Praktyczna, 13.08.2021.
- Advate, Charakterystyka produktu leczniczego.
- Kogenate Bayer, Charakterystyka Produktu Leczniczego.
- Windyga J.: Hemofilie A i B, podyplomie.pl.
- Bjorkman S, Folkesson A, Jonsson S.: Pharmacokinetics and dose requirements of factor VIII over the age range 3-74 years: A population analysis based on 50 patients with long-term prophylactic treatment for haemophilia A. Eur J Clin Pharmacol, 2009; 65: 989-998.
- Bjorkman S, Oh M, Spotts G i wsp.: Population pharmacokinetics of recombinant factor VIII: the relationship of pharmacokinetics to age and body weight. Blood, 2012; 119: 612-618.
- Mingot-Castellano, Parra R, Núñez R i wsp.: Improvement in clinical outcomes and replacement factor VIII use in patient with haemophilia A after factor VIII pharmacokinetic-guided prophylaxis based on Bayesian model with myPKFit. Haemophilia, 2018; 24: e338-e343.











