Prezes Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych wydał 646 pozwoleń na dopuszczenie do obrotu w Polsce produktów leczniczych przeznaczonych do stosowania u ludzi (2020: 483; 2019: 643; 2018: 557; 2017: 824; 2016: 725; 2015: 674; 2014: 599; 2013: 786; 2012: 1269; 2011: 1413; 2010: 1344; 2009: 1164; 2008: 753), w tym 641 pozwoleń dla nowych produktów leczniczych (2020: 471; 2019: 641; 2018: 549; 2017: 816; 2016: 719; 2015: 669; 2014: 586; 2013: 769; 2012: 1254; 2011: 1373; 2010: 1323; 2009: 1121; 2008: 736) i 5 nowych pozwoleń dla produktów leczniczych, które już wcześniej były zarejestrowane (2020: 12; 2019: 2; 2018: 8; 2017: 8; 2016: 6; 2015: 5; 2014: 13; 2013: 9; 2012: 15; 2011: 40; 2010: 21; 2009: 43; 2008: 17). W sumie zostało zarejestrowanych 385 marek produktów leczniczych (2020: 282; 2019: 343; 2018: 321; 2017: 456; 2016: 417; 2015: 394; 2014: 336; 2013: 424; 2012: 615; 2011: 711; 2010: 652; 2009: 523; 2008: 382). Podane liczby nie obejmują pozwoleń dla surowców farmaceutycznych, które nie są ujęte w „Urzędowym Wykazie Produktów Leczniczych Dopuszczonych do Obrotu na Terytorium Rzeczypospolitej Polskiej”.
Komisja Europejska w ramach procedury centralnej wydała 89 decyzji o dopuszczeniu do obrotu produktów leczniczych przeznaczonych do stosowania u ludzi (2020: 90; 2019: 64; 2018: 93; 2017: 92; 2016: 81; 2015: 92; 2014: 74; 2013: 81; 2012: 65; 2011: 78; 2010: 53; 2009: 111; 2008: 55), w tym 52 decyzje dla produktów leczniczych zawierających 52 nowe substancje czynne lub ich połączenia albo oznaczonych jako leki sieroce (tabela 1.) (2020: 44; 2019: 29; 2018: 47; 2017: 36; 2016: 34; 2015: 45; 2014: 37; 2013: 36; 2012: 25; 2011: 23; 2010: 17; 2009: 31; 2008: 25) i 37 decyzji dla produktów leczniczych o substancjach czynnych już wcześniej zarejestrowanych w tej procedurze (2020: 47; 2019: 35; 2018: 46; 2017: 57; 2016: 47; 2015: 47; 2014: 37; 2013: 45; 2012: 40; 2011: 55; 2010: 36; 2009: 80; 2008: 30). W sumie zostało zarejestrowanych 89 marek produktów leczniczych (2020: 90; 2019: 64; 2018: 93; 2017: 92; 2016: 81; 2015: 92; 2014: 74; 2013: 81; 2012: 65; 2011: 78; 2010: 53; 2009: 110; 2008: 55), w tym 17 leków sierocych. Podane liczby nie obejmują produktów leczniczych zarejestrowanych w ramach unijnej procedury centralnej, a sprowadzanych do Polski w ramach importu równoległego. Komisja Europejska zatwierdza zgłoszenia importu równoległego, ale nie publikuje wykazów produktów leczniczych zarejestrowanych centralnie, sprowadzanych do Polski w ramach importu równoległego. Produkty te nie są ujęte osobno w „Urzędowym Wykazie Produktów Leczniczych Dopuszczonych do Obrotu na Terytorium Rzeczypospolitej Polskiej” – ich zbiorczy wykaz nie jest publikowany ani nie jest podawany do wiadomości publicznej w internetowym Biuletynie Informacji Publicznej Urzędu Rejestracji, jednak są pokazywane w wyszukiwarce z Rejestru jako „opakowania z dystrybucji równoległej”. Importerzy równolegli powinni oznaczać je na opakowaniach kodami kreskowymi z własnej puli z GS1 Polska, innymi niż te same produkty lecznicze wprowadzane na rynek przez ich podmioty odpowiedzialne.
Tabela 1. Nowe substancje czynne i substancje czynne dopuszczone jako leki sieroce*, zarejestrowane centralnie w Unii Europejskiej w roku 2021.
| Klasa ATC | Substancja czynna |
| A05AX | Odevixibat* |
| A08AA | Setmelanotide* |
| A16AX | Elivaldogene autotemcel* |
| B03XA | Roxadustat |
| B06AC | Berotralstat |
| C01DX | Vericiguat |
| C10AX | Evinacumab |
| C10AX | Icosapent ethyl |
| D06BX | Tirbanibulin |
| D11AH | Abrocitinib |
| D11AX | Tralokinumab |
| G03AA18 | Estetrol# |
| H01AC | Somapacitan* |
| H01CC54 | Relugolix# |
| J05AX | Baloxavir marboxil |
| J05AX | Casirivimab# |
| J05AX | Imdevimab# |
| J05AX | Fostemsavir |
| J05AX | Regdanvimab |
| J05AX | Sotrovimab |
| J07AL | Pneumococcal polysaccharide conjugate vaccine (15‑valent, adsorbed) |
| J07BX | COVID-19 vaccine (Ad26.COV2-S [recombinant]) |
| J07BX | COVID-19 vaccine (ChAdOx1-S [recombinant]) |
| J07BX | COVID-19 vaccine (recombinant, adjuvanted) |
| L01EE | Selumetinib* |
| L01EH | Tucatinib |
| L01EJ | Fedratinib* |
| L01EL | Zanubrutinib |
| L01EM | Duvelisib |
| L01EX | Pemigatinib* |
| L01EX | Pralsetinib |
| L01EX | Ripretinib* |
| L01EX | Selpercatinib |
| L01XC | Amivantanab |
| L01XC | Dostarlimab |
| L01XC | Moxetumomab pasudotox* |
| L01XC | Sacituzumab govitecan |
| L01XC | Tafasitamab* |
| L01XC | Trastuzumab deruxtecan |
| L01XX | Idecabtagene vicleucel* |
| L01XX | Selinexor |
| L01XX | Tagraxofusp* |
| L04AA | Pegcetacoplan* |
| L04AA | Ponesimod |
| L04AC | Bimekizumab |
| L04AC | Satralizumab* |
| L04AX | Diroximel fumarate |
| M05BX | Vosoritide* |
| M09AX | Risdiplam* |
| N03AX | Cenobamate |
| N05CD | Remimazolam |
| P01BE | Artesunate* |
#jako składnik leku złożonego
Do sprzedaży lub dystrybucji (szczepionki przeciw COVID-19) wprowadzono 214 nowych marek produktów leczniczych (2020: 222; 2019: 286; 2018: 250; 2017: 239; 2016: 235; 2015: 233; 2014: 305; 2013: 277; 2012: 276; 2011: 265; 2010: 335; 2009: 254; 2008: 227).
Tabela 2. Liczba wydanych decyzji rejestracyjnych dla produktów leczniczych w poszczególnych miesiącach roku 2021.
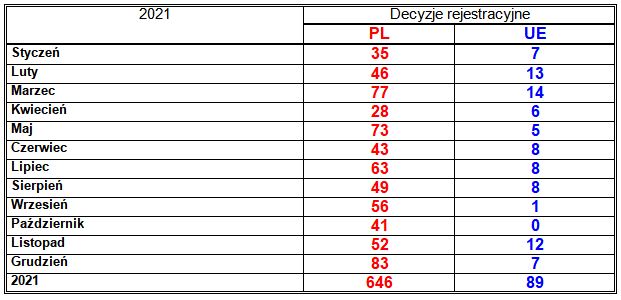
Tabela 3. Podział zarejestrowanych i wprowadzonych na rynek w 2021 roku marek produktów leczniczych według kategorii dostępności.
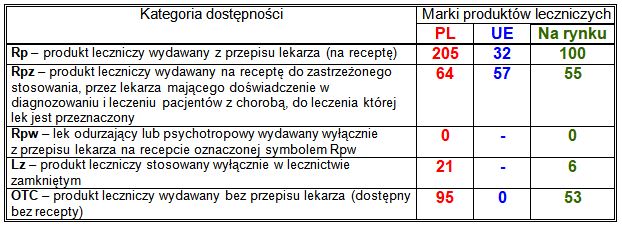
Kategorie dostępności Rpw i Lz istnieją tylko w polskich przepisach prawnych dotyczących produktów leczniczych; nie obejmują produktów z centralnej rejestracji UE. Odpowiednikiem polskich kategorii dostępności Rpw i Lz jest unijna kategoria dostępności Rpz, stosowana także w Polsce. Przedstawiony podział zarejestrowanych produktów leczniczych nie uwzględnia ewentualnych porejestracyjnych zmian kategorii dostępności – podana jest kategoria dostępności obowiązująca w dniu rejestracji.
Tabela 4. Podział zarejestrowanych i wprowadzonych na rynek w 2021 roku marek produktów leczniczych według pierwszego poziomu klasyfikacji ATC (14 klas).

Liczba produktów leczniczych rejestrowanych w poszczególnych klasach ATC zależy od różnych czynników. Najważniejsze z nich to: liczba możliwych chorób, do leczenia których leki z danej klasy są przewidziane oraz liczba wygasających w ciągu roku i w poprzedzającym go czasie patentów na sprawdzone w lecznictwie z dobrym skutkiem substancje czynne. Mniejsze znaczenie dla rejestracji w procedurze narodowej oraz w unijnych procedurach wzajemnego uznania i zdecentralizowanej, które są objęte decyzjami Prezesa Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych, ma liczba wprowadzanych do lecznictwa nowych substancji czynnych, gdyż większość z nich jest obecnie rejestrowana w ramach unijnej procedury scentralizowanej prowadzonej przez Europejską Agencję Produktów Leczniczych (EMA). Większość produktów leczniczych rejestrowanych przez Prezesa Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych stanowią więc preparaty generyczne. Wzrost liczby leków generycznych i biopodobnych można zaobserwować także wśród produktów leczniczych rejestrowanych centralnie przez Komisję Europejską. Należy zauważyć, że niektóre podmioty odpowiedzialne rejestrują produkty lecznicze z tą samą substancją czynną i w tych samych prezentacjach pod kilkoma nazwami handlowymi.
Należy pamiętać, że nie wszystkie rejestrowane w danym roku marki są zupełnie nowe – zestawienie obejmuje także marki produktów już obecnych na rynku lub zarejestrowanych wcześniej, dla których w danym roku rejestrowane są nowe postaci lub dawki.
Duża liczba rejestrowanych i wprowadzanych na rynek nowych marek produktów leczniczych znacznie utrudnia posługiwanie się nazwami handlowymi. Istotne znaczenie mają więc nazwy międzynarodowe produktów leczniczych, których jest mniej, a dla produktów z tych samych grup terapeutycznych tworzone są na podobnej zasadzie, co ułatwia ich zapamiętywanie i kojarzenie z klasą terapeutyczną.










